




 今天小编跟大家分享一篇利用多组学联合分析研究基因突变对癌症发生、发展的经典案例。这篇文章发表在2019年7月26日的Nature杂志上,主要由美国凯特琳癌症中心Sawyers课题组完成,文章使用ATAC-seq、ChIP-seq、RNA-seq等多项前沿测序技术系统阐述转录因子FOXA1突变对自身功能及前列腺癌的影响。下面让我们一睹为快吧~
今天小编跟大家分享一篇利用多组学联合分析研究基因突变对癌症发生、发展的经典案例。这篇文章发表在2019年7月26日的Nature杂志上,主要由美国凯特琳癌症中心Sawyers课题组完成,文章使用ATAC-seq、ChIP-seq、RNA-seq等多项前沿测序技术系统阐述转录因子FOXA1突变对自身功能及前列腺癌的影响。下面让我们一睹为快吧~

研究背景和要解决的科学问题
前列腺癌是男性第二常见癌种,每年导致25万人死亡。FOXA1是驱动型转录因子(pioneer TF)能调控类固醇激素受体的表达,与前列腺癌细胞繁殖和脱分化密切相关,并且可以导致预后不良。目前研究表明FOXA1在前列腺癌中存在两种相悖的功能:FOXA1通过雄激素受体(Androgen receptor,AR)途径诱导前列腺癌细胞繁殖,同时FOXA1也可以通过不依赖AR途径抑制癌细胞迁移和表皮细胞到间充质细胞的转换(epithelialto-mesenchymal transition,EMT)。已有研究表明FOXA1突变能引起一定类别的前列腺癌,但FOXA1在前列腺癌中的突变类型和这些突变对FOXA1功能的影响至今还不清楚。
因此本工作的主要目的就是确认FOXA1在前列腺癌中的临床意义并解析FOXA1突变对其自身功能以及在前列腺癌中的贡献和调控机制。
科学问题拆解
(1)FOXA1在前列腺癌中是否具有临床意义?
(2)FOXA1基因突变对其功能和细胞/组织表型有什么样的影响?
(3)FOXA1基因的调控机制是什么?
实验设计和结果解读
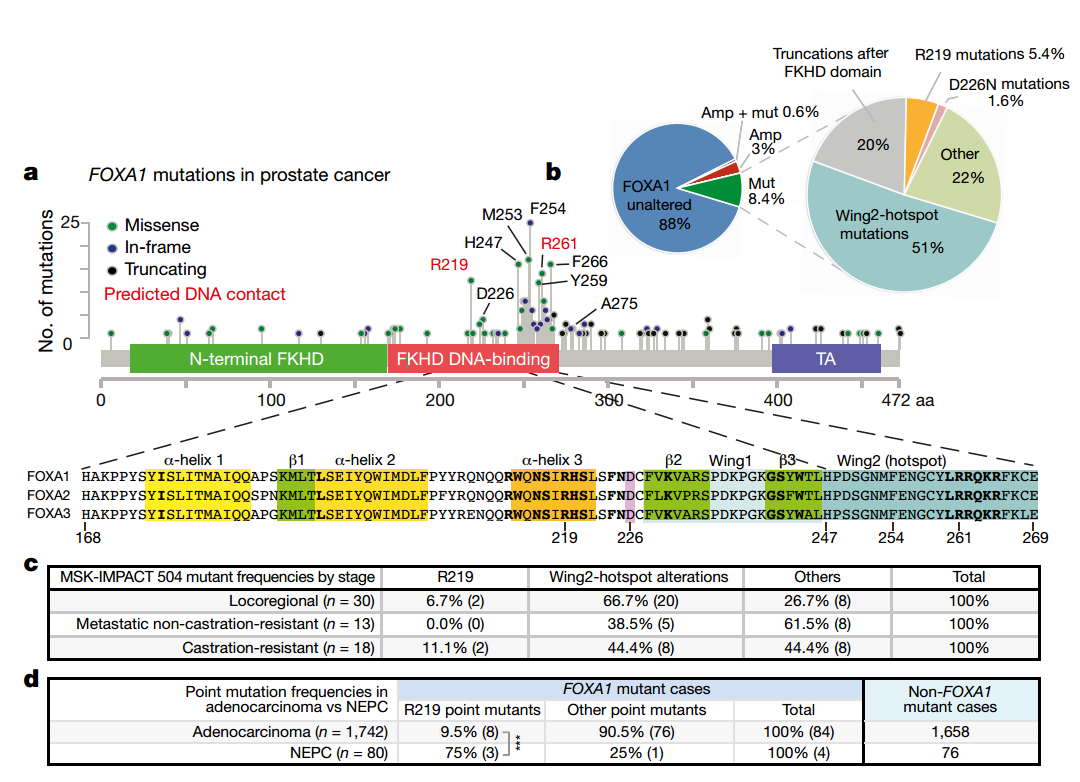
为了揭示FOXA1在列腺癌中的临床意义,作者调查了3086例原发性和转移性前列腺癌组织样本中FOXA1基因突变情况。发现这些病人中FOXA1基因突变的频率为11%,其中3%是基因扩增突变、8.4%是体细胞点突变;约1%的人同时含有以上两种突变。超过50%的FOXA1基因突变热点发生在forkhead(FKHD)DNA结合域的Wing2区域,并且通常为错义突变或插入缺失突变。另一个热点突变发生在R219(α-helix3中结合DNA大沟的位点);最后20%的突变,是C端反式激活结构域的缺失突变。这些突变是否与特定的癌症类型相关呢?作者对这些突变在MSK-IMPACT 504 队列和Weill Cornell的1822队列中的发生情况进行分析,发现:
(1)Wing2区域突变在不同时期的癌症中都存在,但与局部区域的病例更相关;
(2)R219突变在NEPC(neuroendocrine prostate cancer,神经内分泌前列腺癌)中有显著富集(P<0.006);
(3)其它突变类型没有富集。
既然FOXA1在前列腺癌中突变频率很高,突变类型也很复杂,那么这些突变对细胞/组织表型的影响是什么?不同类型的突变间表型是否有差异?
因此作者从突变对FOXA1的表达水平、细胞的生长速度、器官组织特征等方面进行了研究,结果表明:
(1)FOXA1基因的突变对其表达水平有作用。
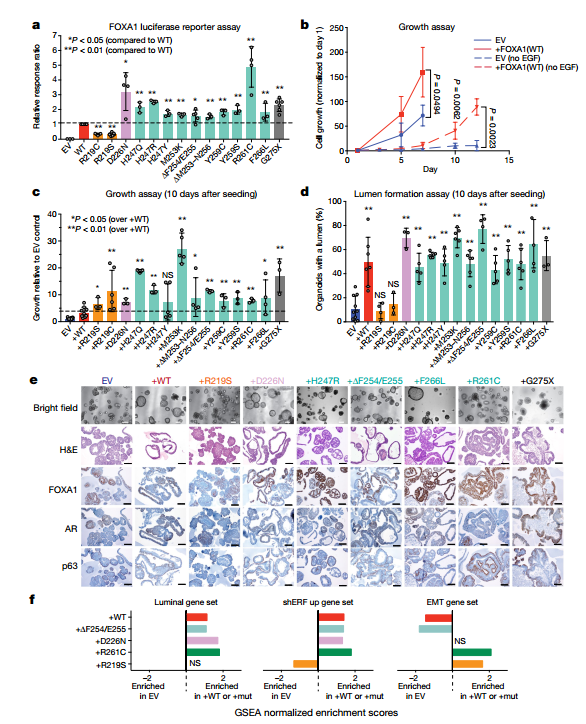
作者使用荧光素酶报告系统检测突变对FOXA1转录活力的影响,发现Wing2突变、D226N(与Wing2邻近的一个突变位点)以及截断的G275X突变提高了FOXA1的转录活性(2倍);而R219位点突变则会降低FOXA1转录活性(50%)。
(2)FOXA1基因促进细胞的生长,FOXA1突变之后效果更加显著。
过表达FOXA1(WT)的细胞生长速度是空白对照的2-3倍,并且当表皮生长因子(EGF,对于正常类器官繁殖至关重要)不存在时,生长差异将达到50倍。而过表达所有类型的FOXA1突变型,细胞相对于过表达WT生长更快,包括转录活性降低的R219S 和 R219C突变。
(3)FOXA1促进内腔的形成,R219是关键
过表达FOXA1(WT)能促进较大的内腔形成。当D226N或者Wing2热点突变后,并不影响内腔的形成;但R219位点突变后(R219S、R219C),则无法形成可测量的内腔。并且R219位点突变后基底的双分子层(p63+)和内腔(雄激素受体阳性,AR+)细胞层紊乱,这种表型与FOXA1缺失产生的表型类似。
(4)动物实验表明,过表达FOXA1(WT)和FOXA1(G275X)能够增加肿瘤的大小;而过表达FOXA1(R219S)则导致侵袭能力和导管基底疾病(AR表达缺失导致)发生增加。
上述结果表明,FOXA1的过表达显著改变了细胞/组织的生长状态及形态,确认了其在前列腺癌发生中的作用,但不同类型突变的作用存在差异。那么FOXA1是如何实现这些调控的?突变是如何影响FOXA1功能的?接下来作者对FOXA1的调控机制,以及突变的影响使用多组学的方法进行了研究:
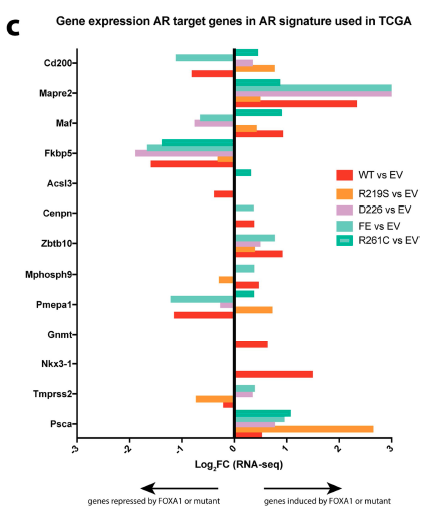
由于FOXA1是AR的辅助因子,且在TCGA数据库中FOXA1突变型与AR相关性更高。因此作者首先使用ChIP-seq实验验证FOXA1及其突变是否影响了AR的作用。
(1)通过过表达野生型或突变的FOXA1基因前后,对AR结合的基因进行ChIP-seq研究,发现FOXA1的过表达能使AR结合的peaks数量显著减少,暗示FOXA1竞争性结合AR的调控基因。
(2)为了验证这个猜想,作者对FOXA1及其突变进行了ChIP-seq研究,发现FOXA1的确可以结合AR结合的基因,且在AR不再结合的位点,FOXA1结合增加,证明FOXA1可能在这些位点替代了AR的功能。
(3)为了进一步证实这一猜想,作者在细胞中敲低AR,发现细胞增长变缓;但在敲低AR的同时过表达FOXA1(WT或突变型),都能使细胞生长加快。另外RNA-seq数据表明AR靶向的基因大部分能够被FOXA1 WT 或突变型诱导表达,进一步证实了这个猜想。

除了AR途径,FOXA1是否通过其他途径调控基因的表达呢?由于FOXA1是一个先驱启动子,能够“打开”紧缩的染色质,因此有可能通过表观的方式对基因表达进行调控。
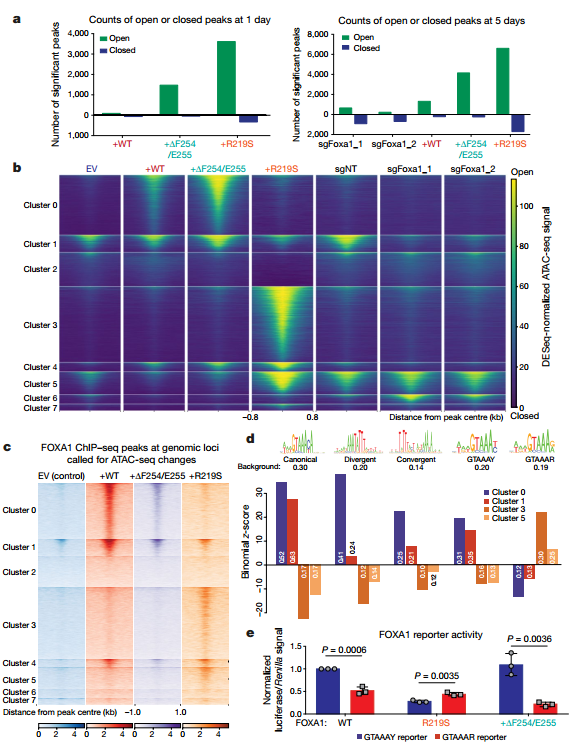
因此作者使用ATAC-seq技术研究了FOXA1对染色质开放程度的影响,发现:
(1)过表达野生型FOXA1后,开放染色质增加(超过100个peak发生显著改变);而敲除FOXA1结果则相反,减少了约1000个peak。
(2)过表达FOXA1突变体(ΔF254/E255和R219S)后,peak数目也增加,并且这种增加会更加迅速(超表达1天后),涉及peaks也更多,这与FOXA1改变的先驱活性一致。
(3)FOXA1不同的突变体(ΔF254/E255和R219S)影响的染色质区域不同:ΔF254/E255使得已开放的区域变得更加开放(cluster0/1);而R219S则会生成新的开放区域(cluster3/5);
那么染色质区域的开放,是否是由FOXA1的结合导致的呢?尤其是R219突变引发的新开放区域,是否是由于R219突变的结合模式改变引起的呢?为了回答这个问题,作者对ChIP-seq、ATAC-seq和RNA-seq进行了联合分析。结果表明, FOXA1结合位点与ATAC-seq位点相同,并且新开放的peaks相关基因表达变化具有突变特异性:
(1)FOXA1野生型和ΔF254/E255突变开放的区域,具有FOXA1的经典motif(GTAAA(C/T);
(2)FOXA1的R219S突变新生成的开放区域则缺少该经典motif。对该区域进行de novo的motif分析发现存在motif(GTAAA(A/G),与经典motif相比其第6位被替换成了(A/G)。
(3)为了验证这种motif是否具有功能,作者再次使用荧光素酶系统实验,发现R219S突变的FOXA1选择性激活第6位为(G/A)的DNA模板,而野生型和ΔF254/E255的FOXA1在含有(C/T)的序列上表现出更高的活性。
上述结果表明R219S突变的FOXA1选择性的结合了新的基因组位点。
总结
在本工作中,作者首先通过大样本发现并同时验证了FOXA1基因在前列腺癌种的临床意义,进而通过细胞学和动物实验对其功能进行了研究,最终通过多组学的研究手段,对FOXA1基因在表观、转录层面的调控,以及突变对基因功能的影响进行了系统的研究。不同癌症类型中特征性的突变基因很多,本文是研究此类基因的非常典型的一篇文章,思路非常清晰,非常值得借鉴:
(1)通过大样本选择待研究的基因,同时揭示其临床普遍性;
(2)通过细胞、动物实验对其表型进行研究;
(3)通过多组学对其调控机制进行研究。实验类型、组学工具的选择与基因的作用方式相关。
武汉康测科技是国内蛋白核酸互作研究的领跑者,具有全面和成熟的表观、转录、转录后研究手段,本文涉及的ChIP-seq、ATAC-seq、RNA-seq等都有优秀的产品为客户服务。我公司拥有动物细胞、动物组织、植物组织、植物愈伤组织、真菌、细菌等复杂材料成熟的ChIP-seq实验体系,拥有严格的质控标准,提供全面的WB质检、IP报告。公司开发的digitalRNA-seq是国内首家绝对定量转录组服务平台,让基因表达研究更精确。同时公司还拥有digital miRNA-seq、digital lncRNA-seq等产品,全方位服务生物学研究。武汉康测产品服务产品给您带来更严谨的实验服务、更精确的数据分析,是您理想的合作伙伴。



