最近小编读到一篇关于m6A修饰的文章,完全被震撼和折服了!!思路之清晰、手段之全面、机制之详尽,让小编甘愿奉上自己的膝盖……毫不夸张的说够得上Cell级别(但是为什么没发Cell呢?),其他生物学过程/领域完全或部分套用这篇文章的思路,10+文章妥妥的!!强烈建议收藏!!长文预警!!

研究背景和待解决的科学问题
癌细胞的转移是癌症致死的最主要原因,超过90%的癌症死亡与转移有关。EMT(上皮细胞-间质细胞转化)则是癌细胞转移过程中极其重要的一个步骤:上皮细胞在变成间充质干细胞的过程中,丧失极性并获得入侵能力。EMT过程的一个重要的标志是E-cadherin表达的丧失。EMT是一个被研究的非常深入的生物学过程,前期的研究表明转录因子Snail通过招募表观遗传修饰蛋白如LSD1(赖氨酸去甲基化酶)和Suv39H1(组蛋白甲基化转移酶)调控CDH1基因的瞬时和长期表达水平。但是在RNA表观遗传调控是否在EMT中发挥作用,到目前还没有报道。
因此,本文要解决的科学问题,就是回答RNA表观遗传是否参与了EMT过程;如果有,那么是否存在核心的调控基因,是谁?
RNA表观遗传目前研究的最多的就是m6A的修饰了。M6A修饰前期已经被报道广泛参与各种生物学过程,如热休克反映、紫外诱导的DNA损伤、神经元功能与性别决定等等,在乳腺癌、肝癌等肿瘤的发生发展中的作用也有报道。因此作者选择对EMT过程中的m6A修饰的功能和作用机制进行研究。有三大类蛋白参与m6A的修饰:
第一类是负责修饰的甲基化转移酶,如METTL3/4、RBM15等;
第二类是去甲基化酶,如FTO、ALKBH5;
第三类是效应蛋白,包括YTHDFs、IGF2BPs等。
这三类蛋白是研究m6A功能的重要的工具。
研究思路解析
1、EMT过程中是否有m6A的参与?
2、EMT过程中m6A调控的核心基因的鉴定;
3、M6A对目的基因的调控机制研究;
4、M6A对目的基因的调控是否与表型相关?
1、EMT过程中是否有m6A的参与?
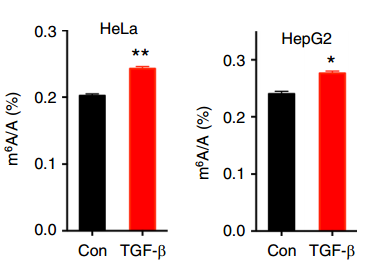
为了回答这个问题,作者使用TGF-b诱导包括Hela、HepG2等多种细胞的EMT,并使用LC-MS/MS对诱导前后RNA的m6A水平进行了鉴定。结果表明诱导之后,细胞内的m6A水平有了显著提高,说明EMT过程中m6A的修饰水平发生了显著变化。
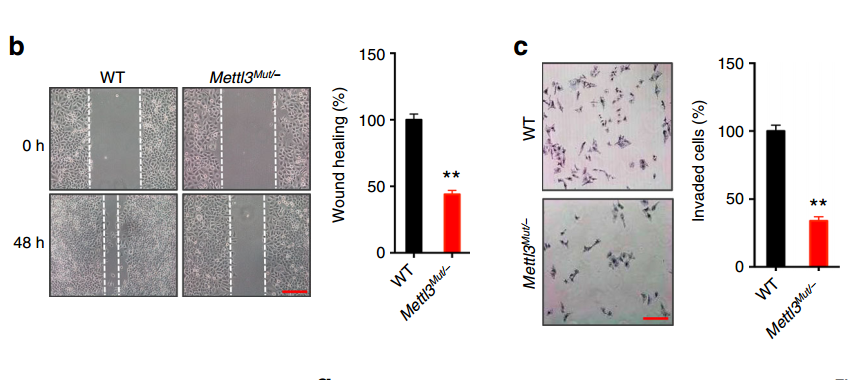
那么m6A的这种变化是否是EMT过程中必要的呢?作者对甲基化转移酶METTL3进行部分敲除(Mettl3Mut/−),降低m6A的修饰水平,然后使用TGF-b进行诱导,观察m6A修饰水平降低对EMT过程是否有影响。结果表明:
(1)Mettl3Mut/−细胞的损伤修复和侵袭能力都有了显著下降;
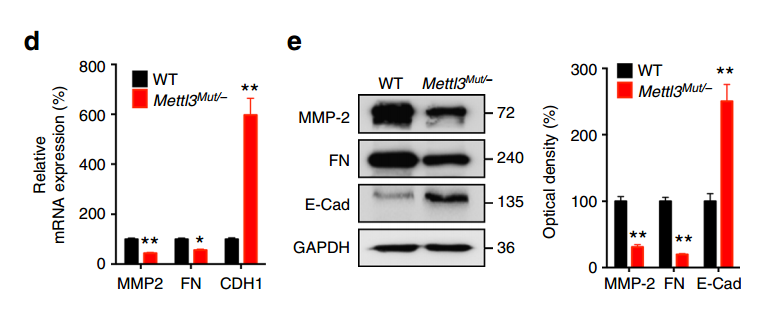
(2)Mettl3Mut/−细胞中mesenchymal标志物如MMP2和FN的RNA和蛋白表达水平都出现显著下降、而epithelial标志物E-Cad的RNA和蛋白水平则显著升高。
这些结果表明METTL3缺失,抑制了细胞的EMT。
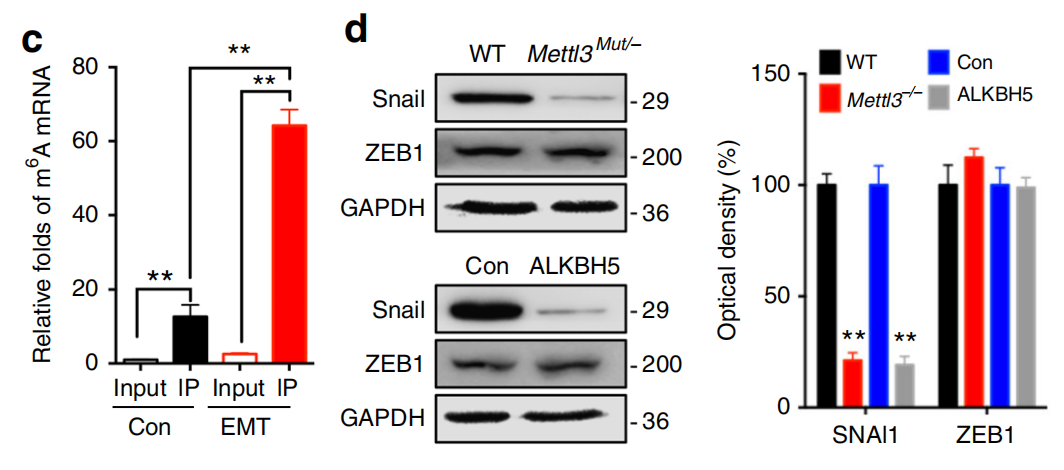
上述METTL3缺失对EMT影响的结果非常显著,但是作者尚不能确定是m6A水平降低引起的:因为METTL3虽然是一个甲基化转移酶,但它还有其他的生物学功能,因此无法将这些作用等同于m6A的作用。为了进一步确认是m6A的贡献,作者过表达了一个去甲基化酶ALKBH5,并对上述的标志物进行了检测,取得了和METTL3敲除同样的效果:
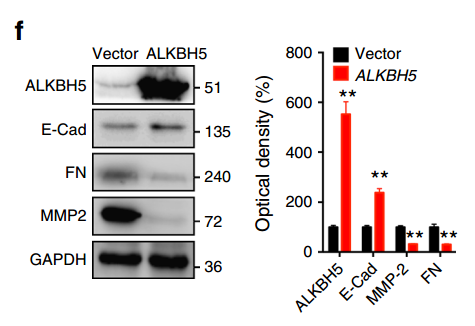
有了这个结果,已经可以下结论:m6A参与了EMT的过程,并且非常重要!!
2、EMT过程中m6A调控的核心基因的鉴定
既然确认m6A在EMT中存在调控功能,因此下一步就是对被调控的基因进行鉴定了。作者使用meRIP-seq实验,对EMT前后细胞中RNA的m6A修饰状况进行了研究。发现EMT前后m6A的motif、RNA功能区的分布和基因组上的分布都没有显著区别,但鉴定出了128个m6A修饰水平存在显著差异(1.5Fold)的基因,这些基因的功能进行分析发现与癌细胞中的粘附连接和肌动蛋白细胞骨架的形成等EMT相关通路。
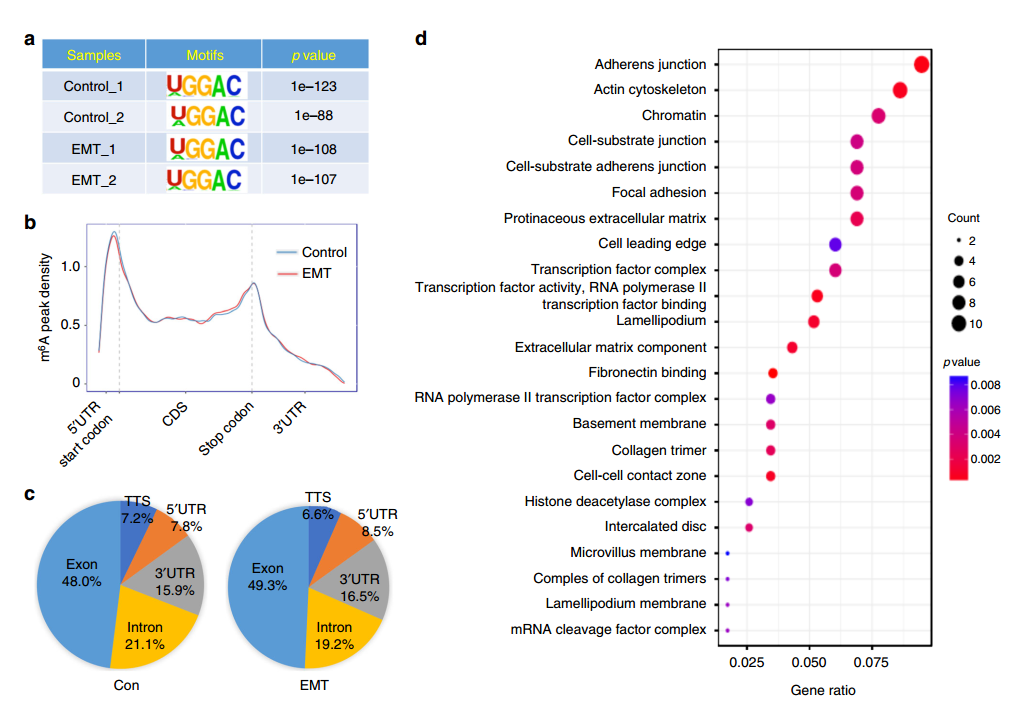
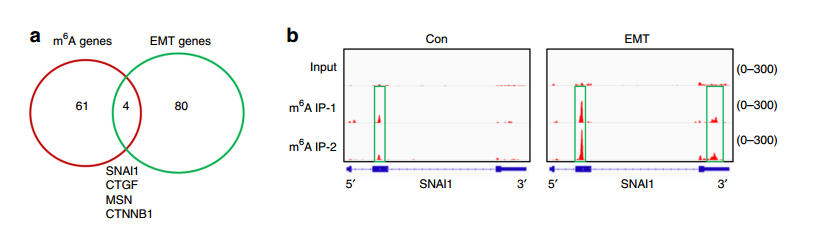
为了进一步缩小范围,找到主效应基因,作者将meRIP-seq中鉴定出来的EMT前后表达显著差异的84个基因和m6A修饰差异超过2倍的65个基因进行overlap分析,发现有4个基因EMT前后m6A水平发生了显著变化,同时表达水平也发生了显著变化,其中包括Snail基因。Snail是一个已知调控EMT的转录因子,因此作者接下来将研究的重点放在Snail上。
作者首先根据meRIP-seq中鉴定出的Snail基因的m6A修饰位点,设计引物使用meRIP-qPCR进行了验证。进而使用Western Blot验证了Snail的表达水平,发现Snail同时受到METTL3和ALKBH5的调控,也就是Snail的表达水平的确受m6A的修饰水平调控。
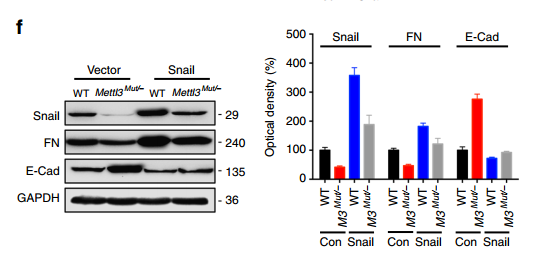
进而作者对Snail在EMT中的功能进行了验证,发现不管是从损伤修复能力还是EMT的蛋白标志物方面,Snail都可以促进EMT的发生,重要的是Snail过表达可以回补METTL3缺失引起的EMT deficiency。

3、M6A对目的基因的调控机制研究;
上面的结果已经证明Snail受m6A修饰调控,那么这个调控发生在什么水平呢?由于这一部分结果太多,小编整理如下:
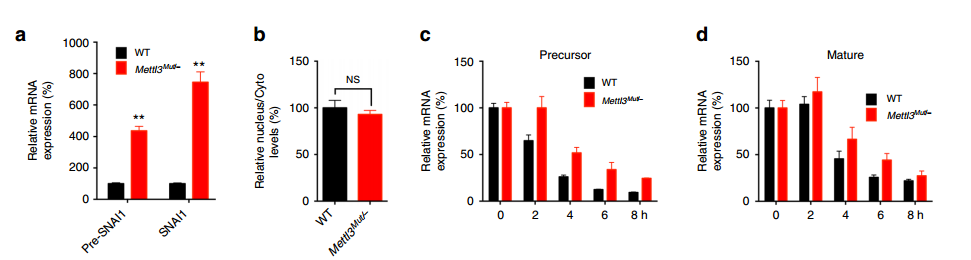
METTL3敲除大幅上调Snail的RNA水平:
(1)qPCR实验验证pre-mRNA和mature mRNA的表达,发现METTL3敲除之后,两者的表达水平都有大幅上升
(2)Leuciferase实验表明METTL3敲除前后,Snail的转录水平没有发生变化;
(3)核质分离鉴定Snail RNA的分布,发现METTL3敲除前后,核质分布没有变化;
(4)Half Life实验表明,METTL3敲除后,pre-mRNA和mature mRNA的stability有了显著提高
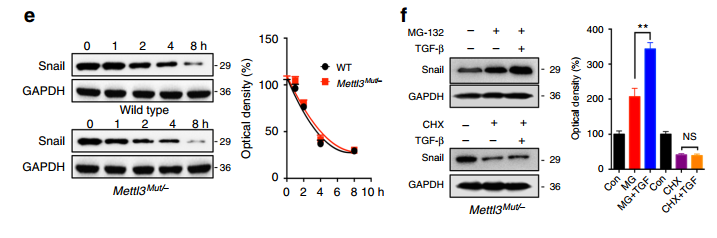
METTL3敲除大幅下调Snail的蛋白水平:
这与蛋白水平的结果完全相反,说明m6A对Snail在蛋白水平存在更强的正调控。因此作者继续进行研究:
(1)蛋白稳定性实验结果表明,METTL3敲除前后对Snail蛋白的稳定性没有影响;
(2)Leuciferase实验结果表明,METTL3敲除之后蛋白的翻译效率大幅降低;
(3)Ribosome Profiling实验结果表明,METTL3敲除之后,polysome的形成大幅降低,说明调控了翻译的延伸过程;
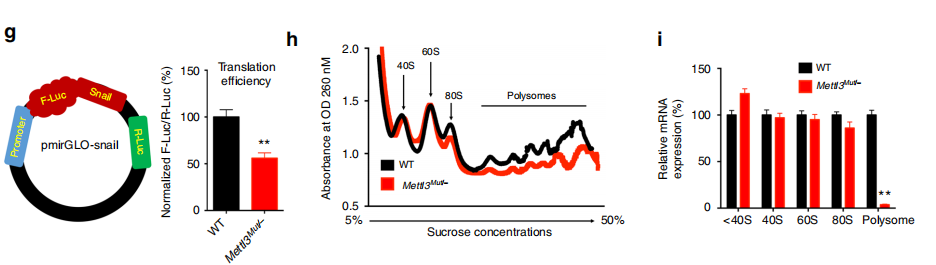
上述结果表明:METTL3(m6A修饰)一方面使Snail RNA变得不稳定,另一方面又大幅提高翻译延伸的效率,叠加后对Snail蛋白水平起正调控作用。那么这个调控又是如何发生的呢?
因此作者接下来做了2方面的工作:1)对Snail RNA上功能修饰位点进行确定;2)鉴定介导翻译延伸效率调控的作用因子。作者对Snail RNA上鉴定出来的3个m6A修饰位点进行了突变并检测其蛋白产物,发现:
(1)3’ UTR的2个修饰位点对翻译没有影响;
(2)CDS上的修饰位点对翻译效率很重要;

从而鉴定出了功能修饰位点,那么又是什么因子介导了修饰的RNA和翻译机器之间的互作呢?作者选择了已知的m6A效应蛋白(reader),YTHDF1进行了验证:
RIP-qPCR结果表明,YTHDF1可以强力结合Snail RNA,并且METLL3敲除之后,结合能力显著减弱;
Western Blot结果表明,YTHDF1敲除之后Snail的蛋白水平有显著下调;
RIP-qPCR结果表明,翻译延伸因子eEF-2对Snail RNA有强力结合,且METTL3敲除之后,结合显著减弱;
Co-IP结果表明,YTHDF1与eEF-2存在互作,且METTL3敲除之后,两者之间结合能力下降。
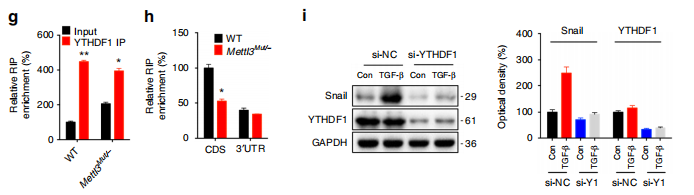
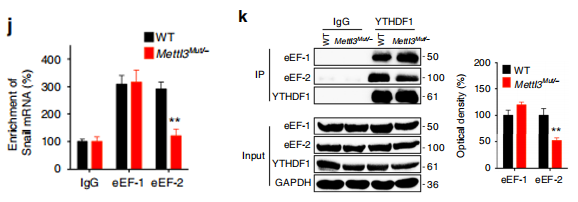
上述结果表明:m6A对Snail蛋白延伸效率的调控,依赖于YTHDF1对其CDS区m6A位点的识别,以及YTHDF1与eEF-2的互作。
4、M6A对目的基因的调控是否与表型相关?
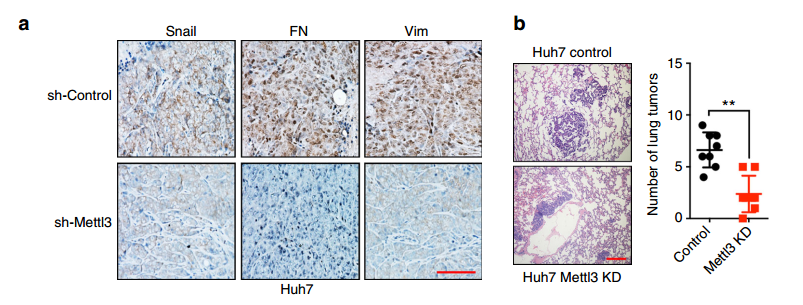
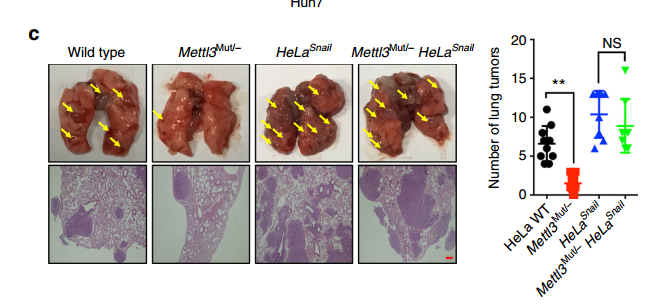
最后作者对METTL3-Snail通路进行了功能验证。作者将对照或sh-METTL3的Huh7细胞注射裸鼠,成瘤后对瘤组织进行IHC检测,发现METTL3敲低后,瘤组织中Snail,FN和Vim表达降低。为体内验证m6A修饰对细胞转移的影响,作者将HeLa WT,Mettl3Mut/- HeLa,HeLaSnail和Mettl3Mut/- HeLaSnail稳定细胞系注射到裸鼠中。结果表明METTL3敲低细胞的肺肿瘤数量显着减少;而Snail的过表达可以回补METTL3敲低的抑制作用,这表明Snail参与了METTL3的体内转移。
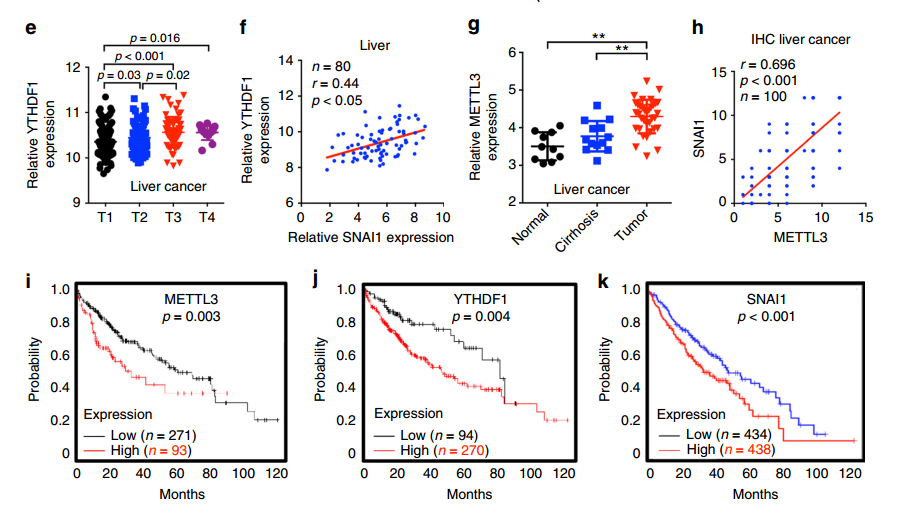
同时作者对TCGA数据库中肝癌的数据进行了分析,发现肝癌组织中METTL3和YTHDF1表达增加、T1至T4期YTHDF1表达水平显着升高、YTHDF1的表达与Snail mRNA的表达正相关、METTL3从正常肝脏到肝硬化到肝癌组织的表达水平上升。另外发现METTL3、YTHDF1和Snail表达增加的肝癌患者显示总体存活率(OS)降低。
总结
先总结一下这篇文章的思路:
1)LC-MS/MS确定EMT过程中有m6A修饰的变化;
2)对METTL3和ALKBH5两个层面证明m6A在EMT中有功能;
3)meRIP鉴定主要被调控的基因,聚焦到Snail上;
4)对Snail及其m6A修饰对EMT的作用进行验证;
5)对m6A修饰如何调控Snail基因的表达机制进行研究
h) RIP-qPCR确定YTHDF1对RNA的结合
i) Co-IP确定eEF-2和YTHDF1的互作
6)对METTL3-Snail通路的功能进行动物实验验证和大样本验证。
本文的前五部分从大到小逐级深入,是研究m6A修饰的教科书级别思路。尤其是第五部分,覆盖了基因表达从转录到翻译全过程的研究方法,值得珍藏并借鉴。但是这篇文章为什么“只能”发NC呢?(以下是小编的一家之言,胡言乱语如有冒犯请装作没看见)小编认为主要是因为筛选出来的基因是Snail:Snail是一个已知的EMT-inducing transcription factor,其在EMT过程中的调控机制已经被研究的非常深入了。
因此本文在m6A如何调控Snail表达这部分做的非常细致,但从snail到EMT就无法继续了,读起来有点头重脚轻的感觉。如果换成一个其他的不是那么well characterized gene,Cell妥妥的。当然,发现什么不是作者自己能决定的,这也不影响这项工作的优秀。小编仍然认为这是一篇参考价值极其高的文献!!



