引言
“对生物学过程进行系统的表观遗传研究,在小编看来是发表高水平文章的最简单的方式,只要收集到有足够生物学意义的样品,系统的获取过程中表观的变化,基本上都可以在top journal上见刊,典型的例子就是2013年发表在Cell上的对胚胎干细胞分化过程中表观研究的文章“Epigenomic Analysis of Mutilineage Differentiation of Human Embryonic Stem Cells”,文章通过将胚胎干细胞诱导成四类不同的细胞,然后对分化前后和不同分化方向的细胞的DNA甲基化、组蛋白修饰和基因表达情况进行了系统的描述。”
今天我们跟大家分享一篇发表在Cell Stem Cell上的文章“Identification and Massively Parallel Characterization of Regulatory Elements Driving Neural Induction”,也是对胚胎干细胞分化过程进行研究,但只有一个分化方向,研究内容同样是表观调控,那么相比前作,创新点在哪里呢?

待解决的科学问题
当前干细胞分化的研究取得了巨大的进展,多项对祖细胞和分化细胞的表观遗传学特性的研究,证明了表观修饰对于基因表达调控的重要性,也阐明了该过程涉及的机制。但是这些研究的共性就是虽然都提供了对全基因组图谱的描述,却没有对候选序列进行大规模功能分析。因此本工作的一个主要目的,就是设法对这些表观研究进行延伸,填补表观遗传到表达模式之间的空白。
实验设计
- 生物学模型:H1胚胎干细胞定向神经分化,分化前及分化的不同时期(0h,3-72h);
- 实验手段:
- H3K27ac、H3K27me3 chip-seq鉴定组蛋白修饰贡献;
- ATAC-seq鉴定染色质构象贡献;
- RNA-seq获得基因表达状态
- lentiMPRA鉴定分化过程中有功能的enhancer
- 预测有功能的转录因子
- Crisperi/a+RNA-seq验证TF功能

结果和主要发现
1.胚胎干细胞神经分化过程中的表观遗传学和表达特征
作者如上文所示对胚胎干细胞进行诱导后,在诱导前和诱导后的不同时间点取样,使用Chip-seq、ATAC-seq和RNA-seq分别对组蛋白修饰、染色质结构在分化过程中的变化以及基因表达情况进行了研究,重点分析了不同分化时期特异的修饰、开放和表达基因,鉴定出了时期特异表达、时期特异H3K27ac修饰、时期特异开放的基因,各2000+。同时发现H3K27me3修饰无显著的时期修饰特异性。
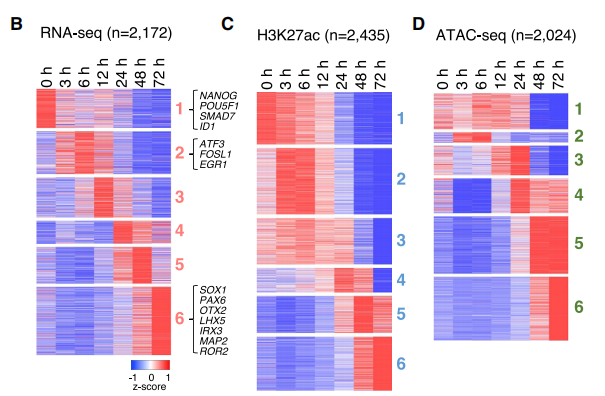
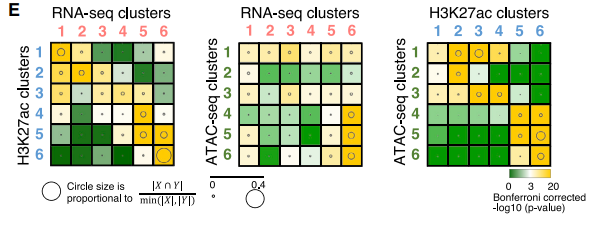
作者比较了这些基因表达、H3K27ac修饰、染色质开放的时期,发现染色质开放的变化先于H3K27ac修饰,最后是基因表达的变化(如下图左,部分RNA cluster5基因与H3K27ac cluster3/4的基因重合,且具备统计学显著性)。
2.胚胎干细胞神经分化过程中时期特异调控区域的筛选和验证
上面一部分的结果,是生物学过程表观调控研究的经典思路,由于胚胎干细胞分化领域前期已经有太多类似的工作,因此作者没有花费太多笔墨,将重点放在了这些受表观调控的基因的功能元件的鉴定和验证上。
为了鉴定潜在的进行时空表达调控的元件,作者综合了上述ATAC-seq、chip-seq和RNA-seq的数据,挑选了在七个时间点中任意时期与神经分化相关的基因。筛选的标准比较复杂,请参考原文。
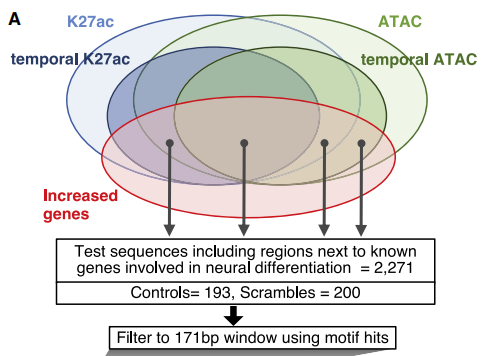
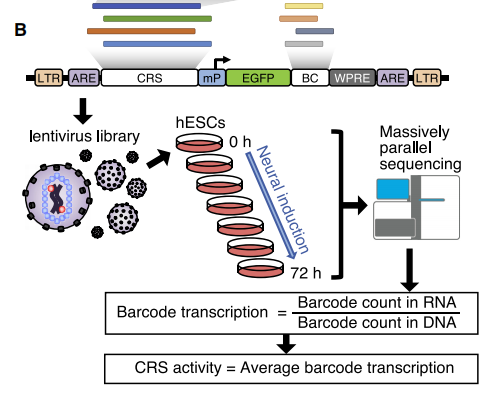
最终作者挑选了2,464个候选序列,涵盖了启动子(n = 386; 15.7%)和假定的增强子(n = 2,078; 84.3%),命名为候选调控序列(CRS)。在这些序列中根据motif确定出171bp的最小功能区,进而构建lentiMPRA系统。
lentiMPRA是2016年发表在Genome Res上的一项高通量验证enhancer是否具备功能的技术。其原理是使用芯片高通量合成待验证的所有enhancer序列,并在每一个enhancer后面合成一段15bp的barcode。在enhancer和barcode之间插入一个最小启动子(mP),插入到载体中、包装病毒并感染细胞。表达一段时间之后,收集细胞对其中病毒的DNA和RNA进行高通量测序。这样每一个enhancer都尤其对应的barcode,因此通过barcode的RNA表达水平(normalize到其DNA拷贝数以去除不同enhancer病毒感染效率差异)进行分析,就可以判断这数千个enhancer是否具有功能,以及活性的高低。
使用lentiMPRA对上述2464个调控序列(CR)进行验证后发现至少68%在一个时间点的功能是显著的。作者选择了5个CR使用leuciferase和Crispra进行了验证,发现这些CR的确是有功能的。对CR在不同时间点的活性进行分析发现,相邻时间点的活性CR在很大程度上是重叠的,时间间隔越远,重叠度越低。这说明在分化过程中这些enhancer的调控是动态的。作者综合了所有时间点的数据以鉴定“时期特异”的调控序列,发现有1547个CR具备这个特征。
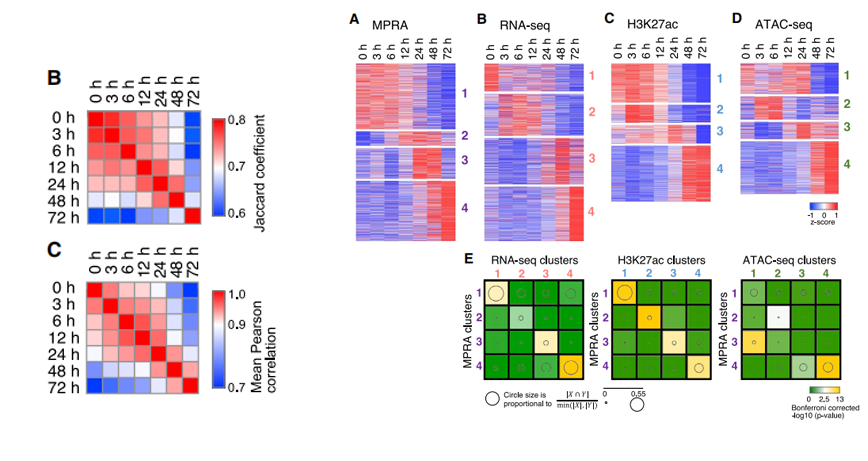
作者进而对这些时期特异的CR的MPRA结果与其RNA-seq、H3K27ac修饰、染色质开放程度ATAC-seq数据进行了如上文一样的overlap分析,发现这些CR的活性与表达具有较好的一致性,但与H3K27ac的修饰状态重叠度最高,相关性最强。
3.胚胎干细胞神经分化过程中时期特异转录因子的筛选和验证
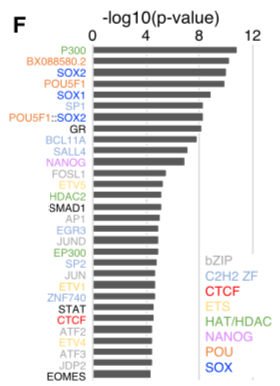
对时期特异的CRS和非时期特异的CRs进行motif分析发现,时期特异的CRs富含:
- 与多能性相关的转录因子如POU5F1,SOX2,SALL4,NANOG和SMAD1(随时间的推移显着下降)的结合位点;
- 与NPC相关的转录因子SOX1(活动随时间显着增加)的结合位点;
- 早期反应因子如AP-1,ATF3和EGR3结合位点的富集,这与细胞对分化刺激的响应相对应。
同时作者发现时间特异的CR中包含了染色质构象调节剂,包括组蛋白乙酰化的调节剂EP300和HDAC和CTCF的结合位点。这表明时期特异的CRs的活化更直接的受表观的调控,而不仅是时期特异的转录因子。
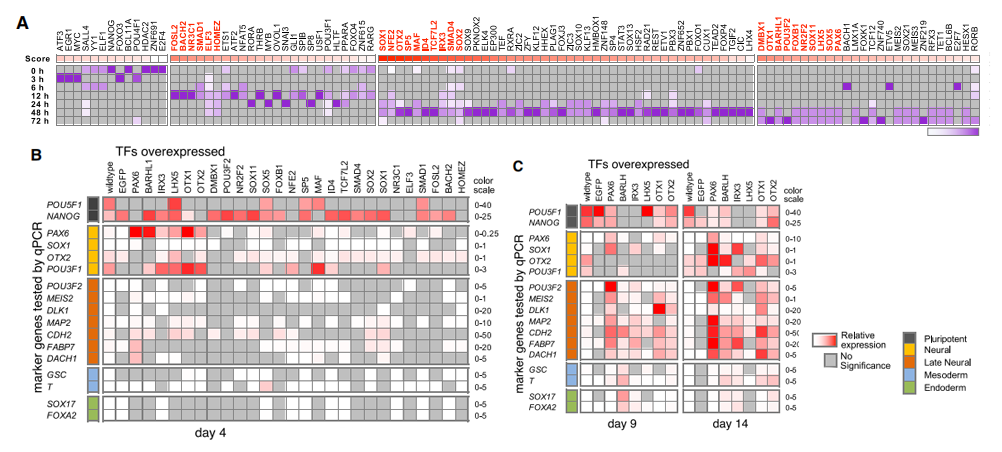
为了鉴定出分化不同时期调控的核心转录因子,作者结合lentiMPRA数据和RNA-seq数据,筛选出了特定时期有活性的CRs中富集的转录因子,然后统计这些转录因子的表达情况,如果它们在结合的CRs有活性之前就有表达,则认为是在该时期有功能的转录因子。通过这种策略,作者筛选出了97个在分化过程四个不同时期:早期、中早期、中晚期、晚期有功能的转录因子(下图A)。并挑选了26个(下图A红色)在不同时期有功能的转录因子,在分化的不同时间点进行过表达,验证其靶基因的激活情况。结果表明这些转录因子的确是在相应的时期在发挥功能。
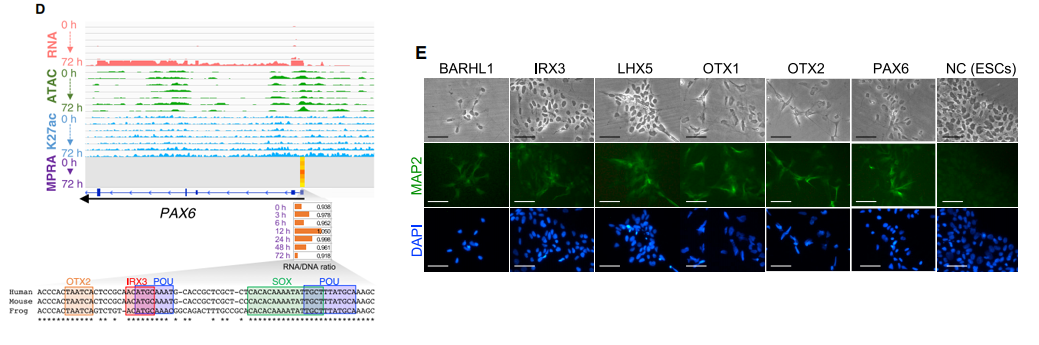
最后,作者进一步缩小范围,筛选神经分化过程中的核心转录因子。PAX6a的过表达可作为神经外胚层命运的决定因素,并且先前已证明可诱导hESCs进入神经系。作者在PAX6基因启动子区鉴定出5个潜在有调控功能的转录因子;BARHL1, IRX3, LHX5, OTX1和OTX2,并在细胞系水平发现这些转录因子的过表达的确可以诱导神经分化。
分析
表观遗传学研究的最大的缺陷是全基因组范围内鉴定出潜在有功能的修饰之后,只能进行相关性的研究,缺乏进一步机制研究的手段。本文采用的lentiMPRA方法提供了一个很好的思路。使用这种方法,我们能够对数千个CRS进行功能测试,并确定出关键的转录调控因素。
在本文中,作者使用这种方法确定了BARHL1,IRX3,LHX5,OTX1和OTX2是神经诱导的重要调控因素,它们的过表达和敲除分别使PAX6和其他神经标记物上调和下调。前期工作已经发现PAX6在hESCs中的表达是通过OTX2上调的,本文一次鉴定出4个新的转录因子,意义不能说不大。
希望这种新的研究手段能够为大家所采用,大大推进表观调控的研究。
本文链接:https://doi.org/10.1016/j.stem.2019.09.010。需要pdf的老师也可以在文章下方留言索取~~



