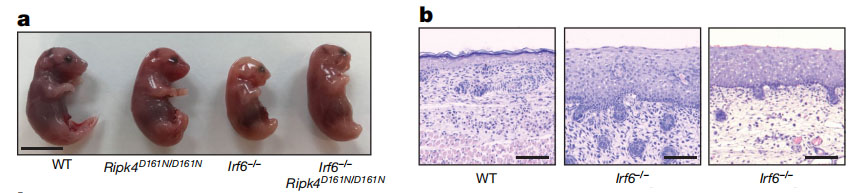
前期的研究表明,RIPK4基因突变会导致巴索卡-帕帕斯综合征 ( BPS),表现为颅面、生殖器官和全身皮肤异常。为了验证RIK4酶活对于表皮细胞分化是否是必需的,作者构建了RIPK4酶活缺失的Ripk4D161N/D161N knock-in小鼠模型。结果表明,Ripk4D161N/D161N knock-in小鼠胚胎与Ripk4-/-类似,皮肤较厚且富有光泽(图1a),所有外部孔口融合在一起(图1b);皮肤的组织学分析显示表皮和基底细胞存在增生,角质层存在角化不全(图1c,d)。因此,RIPK4的激酶活性对于小鼠的发育和表皮分化至关重要。

类似的,IRF6的突变会导致翼状胬肉综合征(PPS),这是一种较轻的BPS的形式。缺少IRF6的小鼠,和缺失Ripk4的小鼠一样,表现出软组织融合、表皮增生和角化不全。除此之外它们还表现出在Ripk4 − / −或Ripk4D161N / D161N小鼠中没有的骨骼异常。上面的种种证据提示,RIPK4和IRF6可能在同一个通路中起作用,加之前期报道表明RIPK4可以在体外磷酸化IRF6,因此作者猜想RIPK4和IRF6在皮肤细胞分化过程中可能存在上下游的线性调控关系。
为了验证这一猜想,作者使用K14-Cre分别构建了RIPK4和IRF6的条件敲除突变体Ripk4EKO和Irf6EKO,在表皮中特异性缺乏RIPK4和IRF6。Ripk4EKO和Irf6EKO小鼠表皮均显示出增生,棘突层扩张,颗粒层节段性丧失和局灶性角化不全。Ripk4EKO和Irf6EKO小鼠均未显示软组织融合。这些结果表明,在表皮中RIPK4和IRF6似乎执行相同的功能。
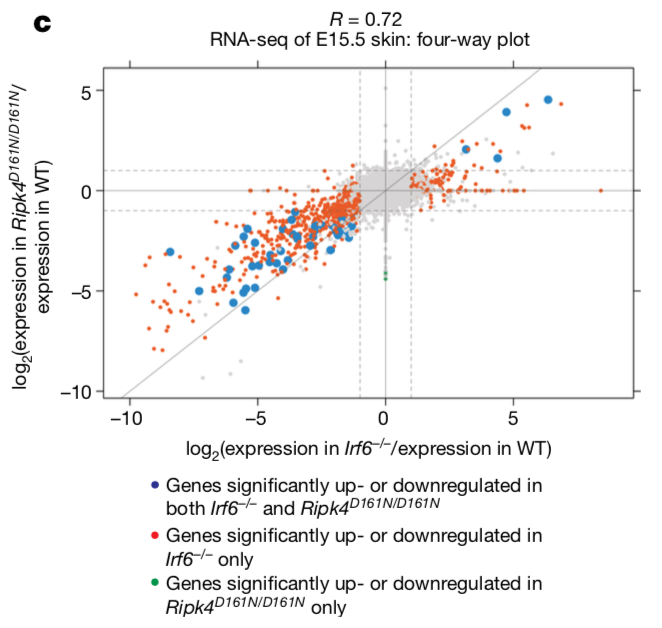
进一步对上述突变体的表皮进行RNA-seq测序,发现2种突变体的表达变化非常一致。更有意思的是,Ripk4D161N/D161N组检测到变化的基因全包含在Irf6-/-组内,这说明IRF6激活可能是以RIPK4依赖和非依赖两种方式共同存在的。
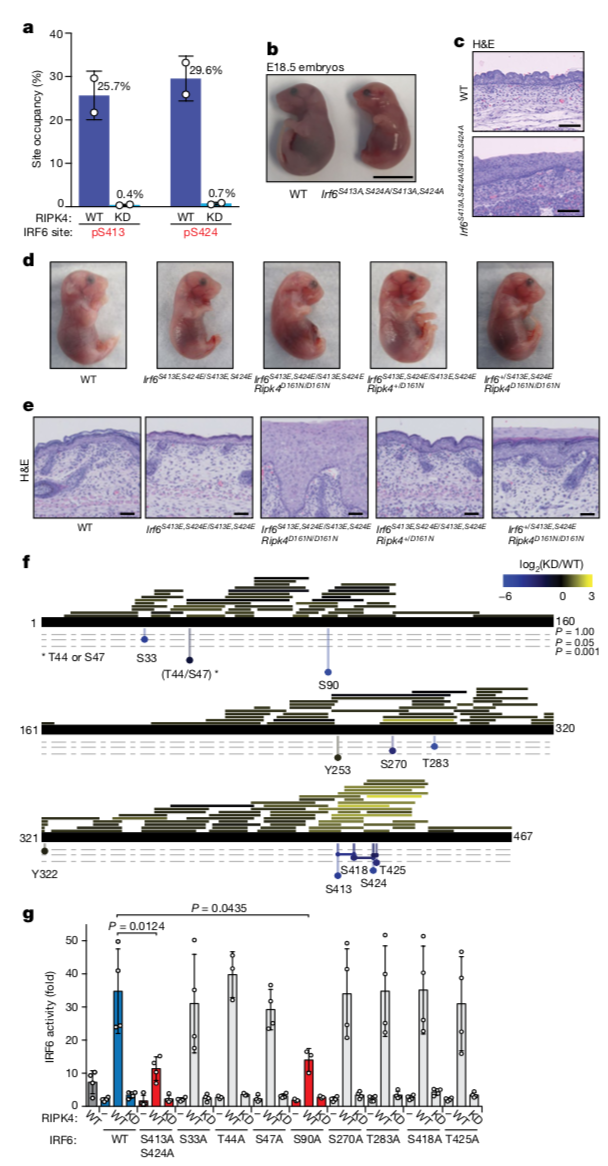
IRF蛋白家族C端结构域的磷酸化往往与其转录活性相关,并且作者用质谱验证RIPK4的确可以在体内磷酸化Ser413和Ser424位点,因此作者猜测将这两个磷酸化位点突变掉应该可以模拟IRF6缺失带来的影响。于是,作者构建了Irf6S413A,S424A/S413A,S424A小鼠模型,并发现该小鼠表型与Irf6-/-小鼠一致,说明这两个磷酸化位点对于IRF6的功能的确很重要。但出乎意料的是,作者在Ripk4D161N/D161N小鼠基础上再去敲入模拟这两个位点磷酸化的突变体——Irf6S413E,S424E/S413E,S424ERipk4D161N/D161N却不能挽救小鼠表皮发育异常的表型,这提示除了这两个已知磷酸化位点可能还有别的位点对于IRF6的功能也很关键。因此作者通过SILAC和质谱分析,在IRF6中发现了另外10个磷酸化位点,其中Ser90对RIPK4的依赖性最高。实际上,当突变为丙氨酸时,导致IRF6活性降低的唯一位点是Ser90,这表明Ser90可能是激活它所必需的其他IRF6位点。
尽管作者揭示了RIPK4了与IRF6之间的调控机制,但仍不清楚的是IRF6如何控制表皮细胞的分化?通过结合RNA-seq,ATAC-seq和CHIP-seq三种技术手段在野生型和Irf6-/-E16.5全皮肤上鉴定IRF6靶基因。RNA-seq分析显示,与野生型皮肤相比,Irf6-/-中有1,226个基因显着下调,而458个显着上调。
作者检查了组蛋白ChIP-seq和ATAC-seq数据,以确定是否有任何参与脂质代谢或紧密连接的基因是IRF6的靶标。结果表明,IRF6能够识别并结合干扰素刺激的反应元件(ISRE)。作者在H3K4me3 ChIP-seq数据集中检测到ISRE基序,这表明IRF6结合位点可能在启动子上富集。
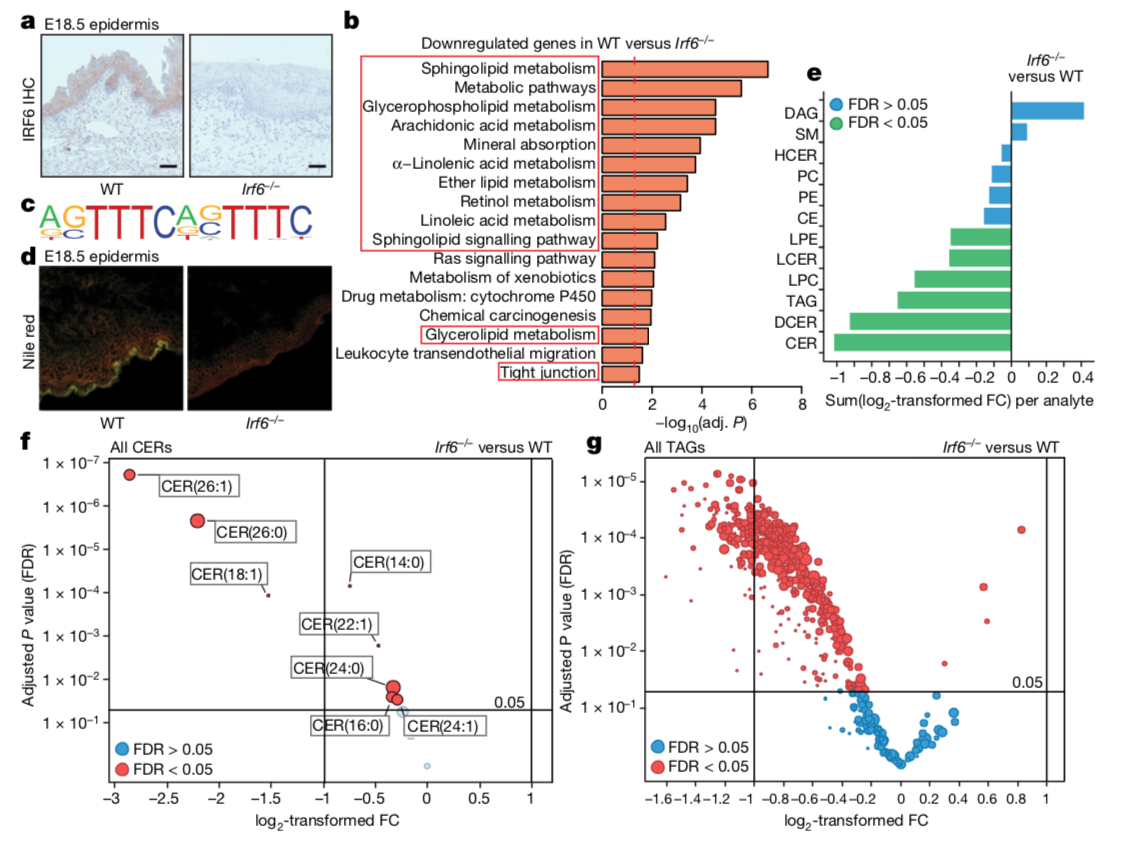
通过将IRF6基序数据与ATAC-seq和RNA-seq数据结合,作者确定了66个高置信度IRF6目标基因。在Irf6-/-皮肤中,这其中45个基因被下调。而这45个基因中有4个与角质层的脂质合成相关 (Pnpla1, Cers3, Sptlc3 and Rora) 。

考虑到脂质合成对于皮肤屏障至关重要,并且在表皮发育缺陷病人中存在这几个基因的突变。因此作者考察了一下Irf6-/-小鼠脂质合成是否出现问题,结果表明Irf6-/-小鼠角质层脂质沉积异常并且皮肤屏障受损。
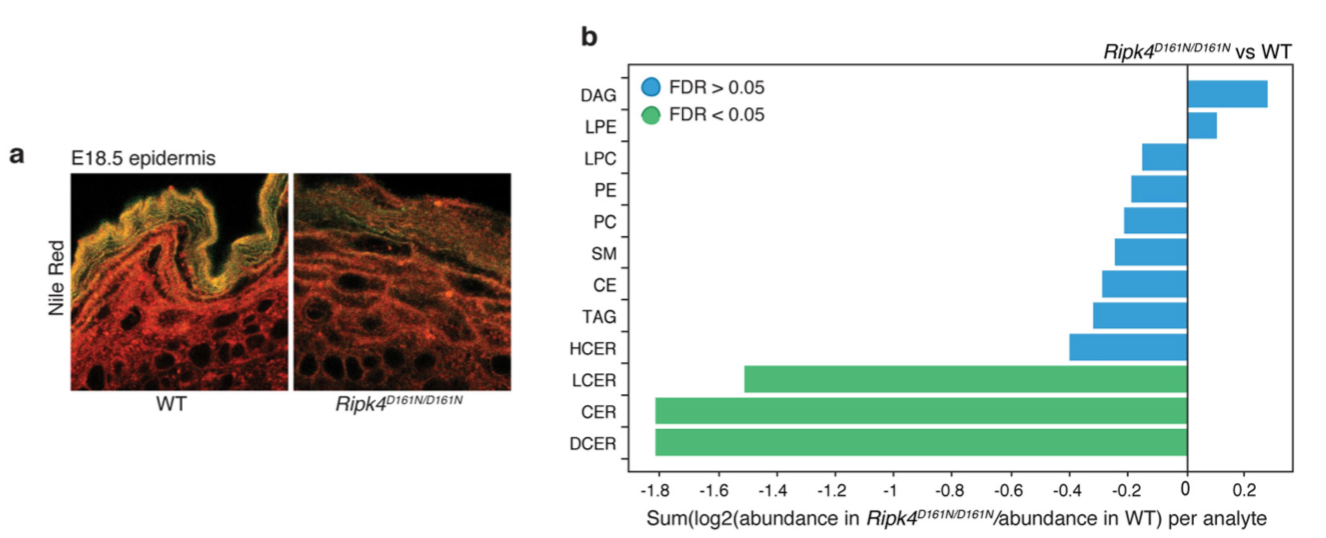
因此,本工作在体内证实RIPK4-IRF6信号轴是以转录形式调控表皮细胞的脂质合成从而维持皮肤屏障的正常功能。



