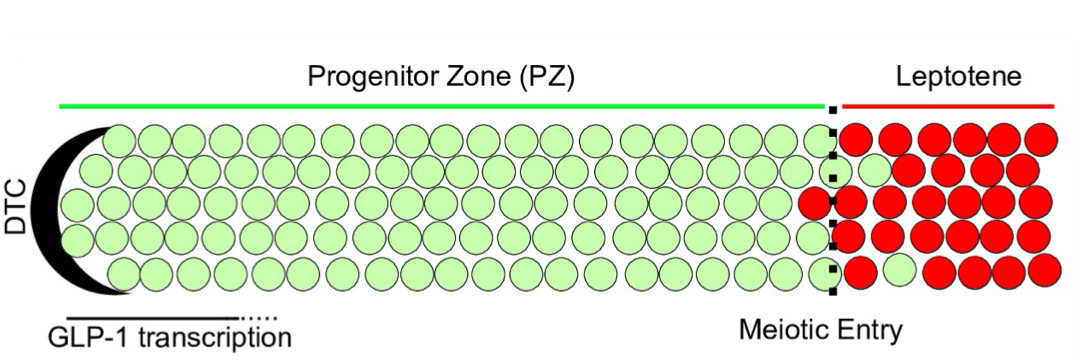
线虫的结构是极化的管状细胞群,包含大量的生殖干细胞的祖细胞区(下图绿)被远端末梢细胞(Distal Tip Cell,DTC)覆盖。靠近DTC的生殖干细胞进行有丝分裂维持干性,远离DTC的干细胞则会进入减数分裂并进行配子发生。
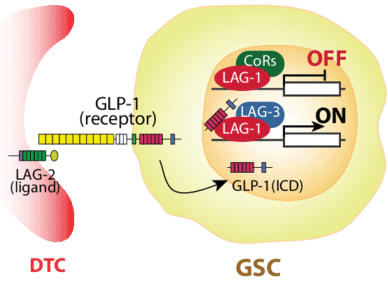
干细胞干性的维持是DTC通过Notch通路实现的。DTC表达GLP-1 / Notch配体(例如LAG-2),并与干细胞跨膜表达的GLP-1受体相互作用时,受体胞内部分会切割生成GLP-1 intracellular domain,GLP-1(ICD),该结构域定位到细胞核中并与序列特异性DNA结合蛋白LAG-1结合,激活主要靶基因的转录。
前期研究表明LST-1和SYGL-1是GLP-1信号通路的2个基础靶基因,LST-1和SYGL-1蛋白可以和PUF家族中的FBF-1和FBF-2结合,通过调控mRNA降解和蛋白质翻译抑制,从而参与干细胞命运决定。但GLP-1信号通路是否还有其他直接作用的基础靶基因,目前尚无系统研究。
因此,本工作的目的,就是希望通过鉴定被LAG-1直接调控的基因,从而系统鉴定GLP-1信号通路的其他基础靶基因。
作者是如何实现这个目的的呢?由于GLP-1/Notch-LAG-1调控轴已经研究的非常清楚,因此作者这里解决的主要问题,就是从LAG-1出发往下游进行研究,鉴定出LAG-1直接调控的基因。请跟随小编的思路,一起来看作者是如何设计的。
1.LAG-1 的定位以及功能确认
作者使用crisper技术构建了LAG-1的荧光融合蛋白,对其在线虫细胞中的定位进行了研究,发现LAG-1在mid-L4线虫中主要分布于祖细胞区的干细胞中(下图C),而在成虫中除了干细胞中有表达之外,在粗线期、双线期和丝球期的卵母细胞中也有表达(下图B)。
【这个结果很重要哦,直接决定了后面的实验策略】。
进而作者构建了融合了degron的LAG-1转基因线虫,之后使用Auxin通过降解degron降解掉LAG-1,发现LAG-1降解24h之后,干细胞都进入了减数分裂,丧失了干性(下图DE)。
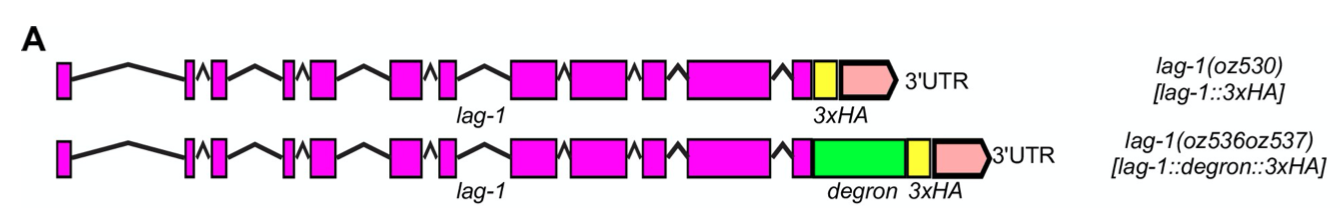
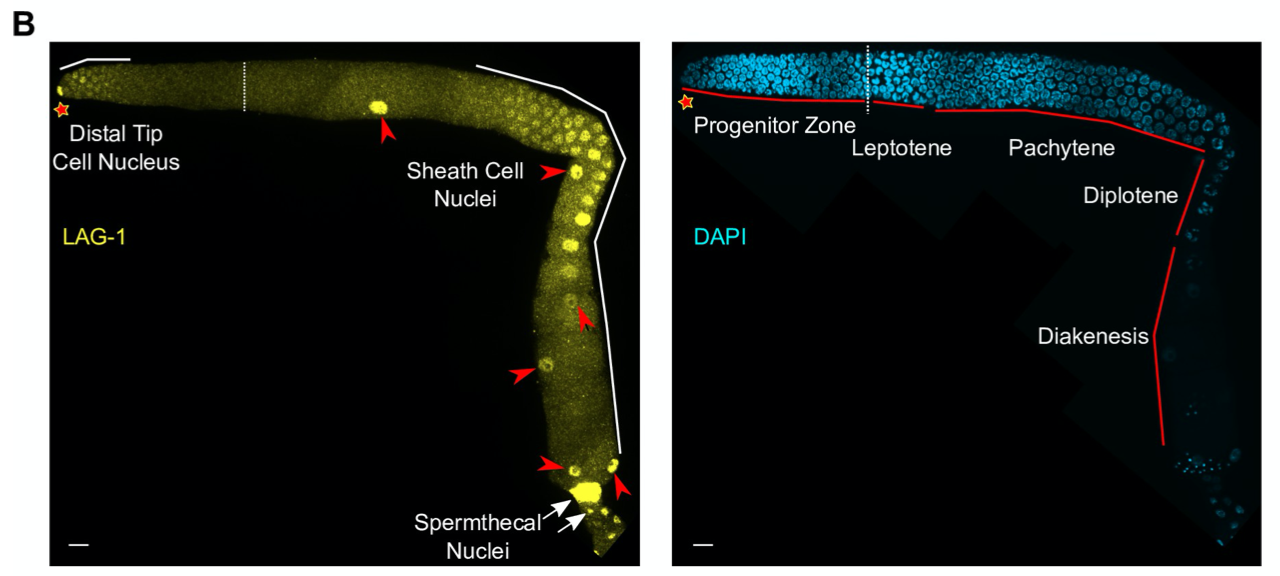
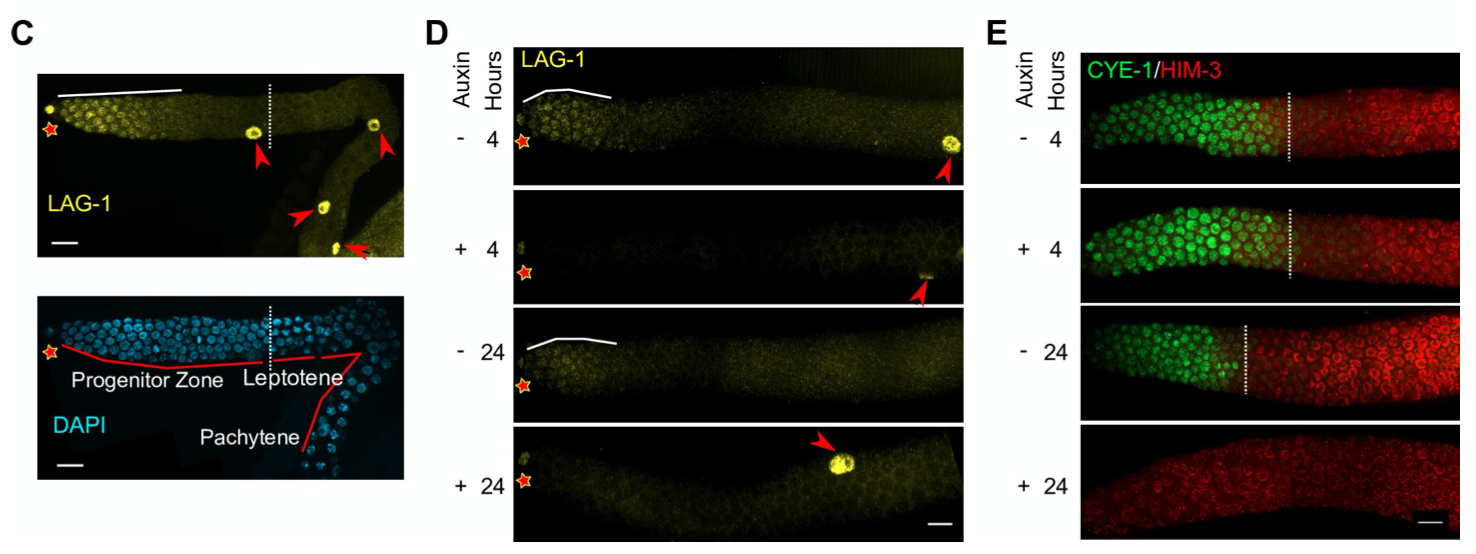
2.LAG-1 自身的调控
GLP-1主要是通过ICD实现对LAG-1功能上的激活,但LAG-1自身的表达又是受什么调控的呢?作者通过在GLP-1通路基因的突变线虫中LAG-1的表达和定位情况,发现LAG-1的表达也部分受到GLP-1通路的转录后调控。
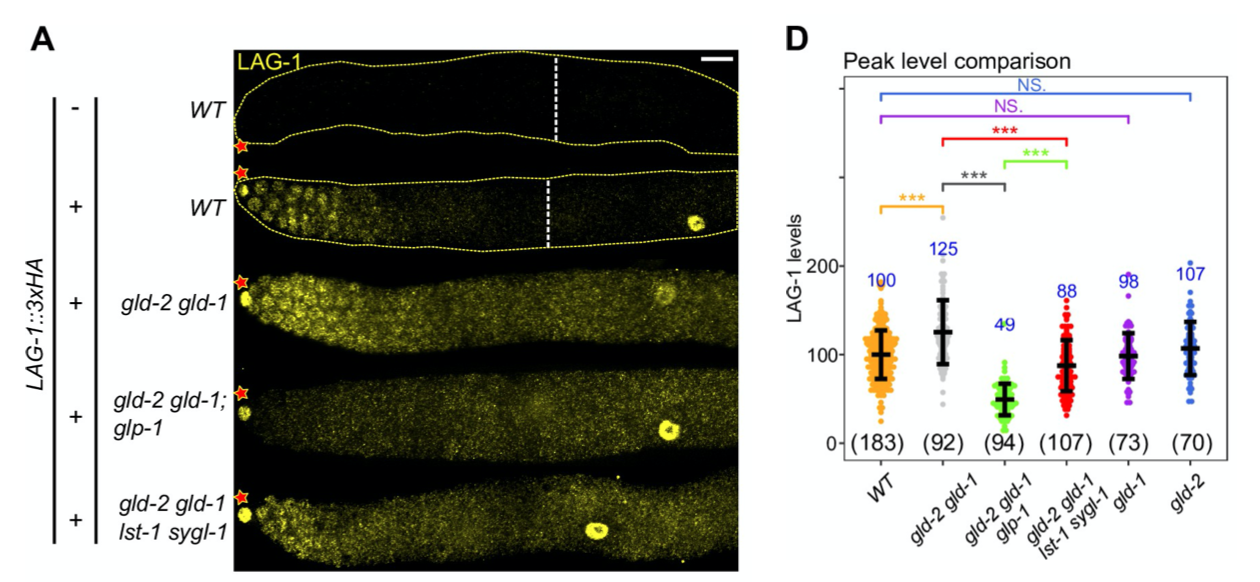
上述是单基因研究的基础思路,对目的基因的功能、表型进行验证,证实其生物学功能。接下来进入对LAG-1的调控机制研究。由于LAG-1是一个转录因子,因此本研究的目的,就是鉴定LAG-1调控的靶基因。经常关注我们公众号的读者应该清楚,如何去鉴定一个转录因子靶基因:直接结合+表达受调控。
3.LAG-1 结合基因的鉴定
当然是Chip-seq啦!!那么取了虫子,进行Chip-seq就可以了吗?没有那么简单:
作者的目的是研究LAG-1在干细胞干性维持中的调控机制,但是从图1B中我们可以发现,LAG-1可不仅仅在干细胞中表达,而且在干细胞中的表达量也不是最高的!!如果取了全虫进行Chip,获得到的可不仅仅是干细胞中LAG-1调控的基因了!!
因此,作者需要像一个办法,仅仅鉴定LAG-1在干细胞中结合的基因是哪些?怎么做的呢?
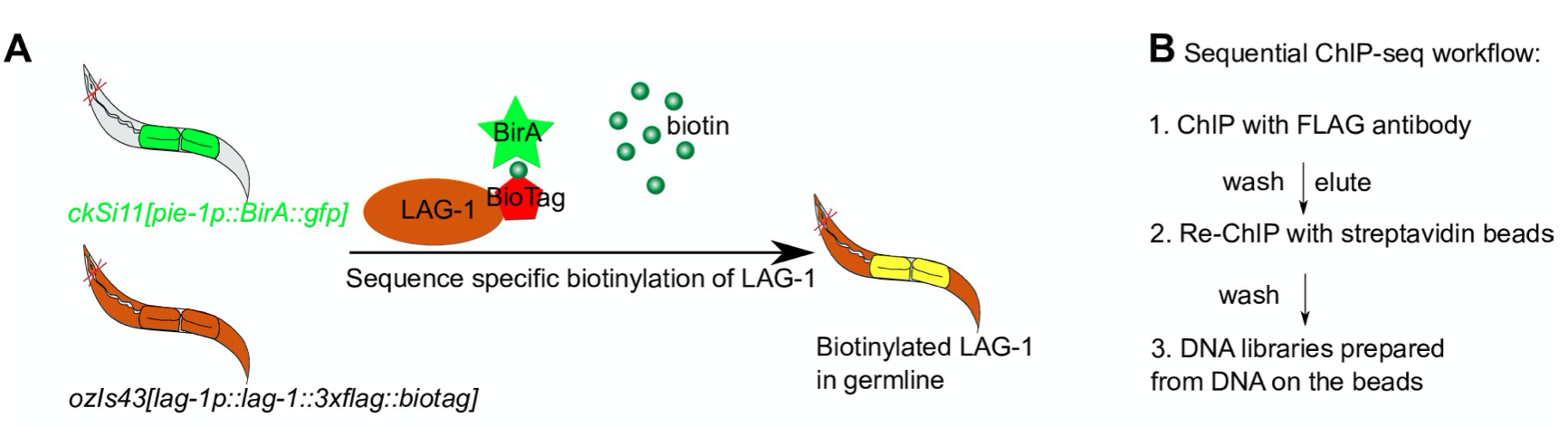
(1)作者首先构建了lag-1突变株,并在该突变株内超表达末端融合了3x FLAG标签和一个biotag标签的LAG-1;同时作者用内源pie-1启动子启动BirA生物素连接酶的表达;
- LAG-1末端的biotag可以被BirA生物素连接酶进行生物素化;
- pie-1启动子只在生殖干细胞中表达;
因此,该株系构建成功之后,LAG-1将在所有细胞中组成性表达;而BirA生物素连接酶只在生殖干细胞中表达;最终,只有在生殖干细胞中表达的LAG-1可以被生物素化;
(2)作者进而使用连续的Chip来获得生殖干细胞中表达的LAG-1结合的DNA:
- 首先使用FLAG抗体,捕获所有的LAG-1蛋白和其结合的DNA;
- 进而使用链霉素对捕获产物进行二次捕获,获得生物素化的LAG-1及其结合的DNA;
将连续ChIP得到的DNA进行二代测序并分析,三次重复鉴定出与137个LAG-1结合基因。其中前期已知的靶基因lst-1和sygl-1都含有单一显著的peak,这说明了结果的可靠性,也为lst-1和sygl-1是GLP-1信号通路的直接转录靶点提供了直接证据。

4.GLP-1/Notch-LAG-1 调控基因及直接调控靶标的鉴定
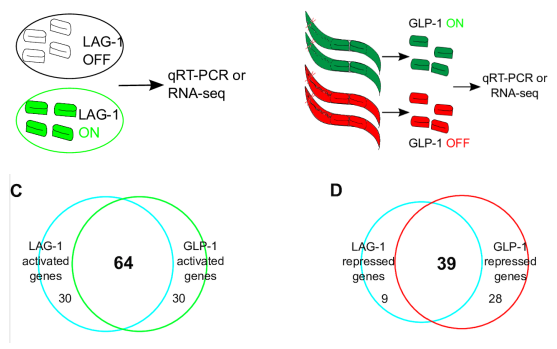
作者通过对超表达GLP-1的ar202株(GLP-1 ON),和缺失GLP-1的q175株(GLP-1 OFF)进行RNA-seq,通过差异分析,得到了94个基因的表达受GLP-1/Notch-LAG-1通路直接或间接调控。作者对LAG-1直接结合的137个基因和受GLP-1/Notch-LAG-1调控的94个基因进行overlap,获得了2个GLP-1/Notch-LAG-1通路直接调控的基因:lst-1和sygl-1.都是已知的。
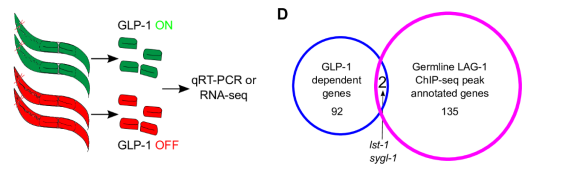
上述overlap的基因只有2个,实在是太少,那么就存在2中可能:
- GLP-1/Notch-LAG-1通路的基础靶基因就是这2个,其他的被调控基因都是受其调控的次级调控基因;
- GLP-1/Notch有不依赖于LAG-1的通路;LAG-1有独立于GLP-1/Notch通路的调控机制;
因此研究进展到这里,去伪存真就很重要,因此作者设计了2类实验来对上面的2种可能进行验证:
5.GLP-1/Notch-LAG-1通路
作者通过上面构建的系统,对LAG-1降解前后的基因表达情况,和GLP-1 ON/OFF前后的基因表达情况分别进行了转录组测序,然后分析GLP-1依赖和LAG-1依赖基因的重合情况。结果表明:
- 在94个依赖于LAG-1表达的基因中,有70%同样依赖于GLP-1信号通路表达;
- 在48个受LAG-1抑制的的基因中,有80%同样受GLP-1信号通路抑制;
考虑到上述ON/OFF系统无法达到100%的效率,因此这个大多数重合的结果表明:LAG-1并无独立于GLP-1信号通路的功能。因此这些被调控的基因都应该是受次级调控的基因。
6.基础/次级调控基因的表达模式
如果GLP-1/Notch-LAG-1通过调控lst-1和sygl-1的表达,进而调控下游相关基因表达,那么这些基因的表达应该和lst-1/sygl-1表现出一定的顺序性。因此作者使用Auxin降解LAG-1,然后在不同时间使用RNA-seq检测相关基因的表达情况:
- Auxin处理2h后,只有lst-1和sygl-1受LAG-1降解的影响表达量降低;
- Auxin处理4h后,另外5个基因(epg-5, tbx-2, C17H12.36, ucr-2.1, F40D4.13)的表达也显著下降。
这表明lst-1和sygl-1是最先响应LAG-1表达下降的;同时前面的ChIP-seq数据中这5个基因上并无LAG-1结合,它们也不含有LAG-1/CSL蛋白家族的经典结合位点。这些证据表明,这5个基因不是收到LAG-1直接调控,而是响应lst-1和sygl-1次级调控的产物。
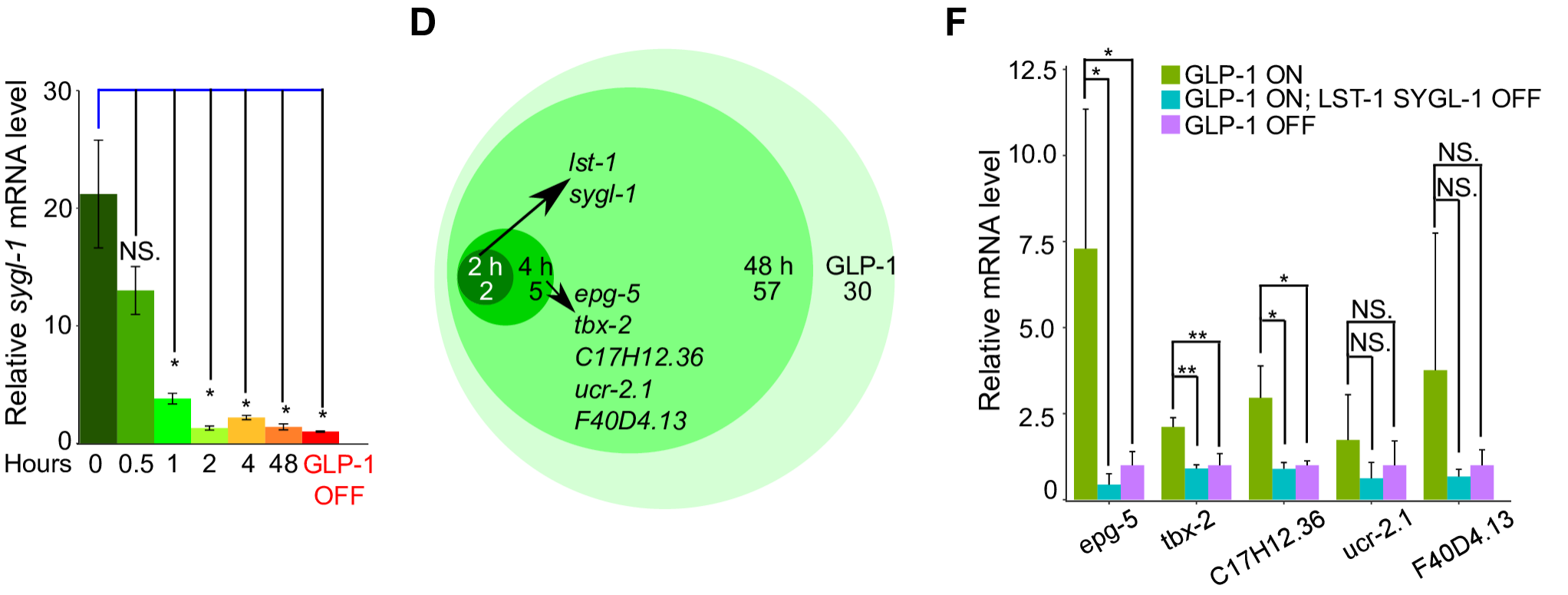
为了进一步证实,作者用qPCR进行了验证,结果显示即使在GLP-1信号通路发挥作用,但如果不含有lst-1和sygl-1,5个基因(epg-5, tbx-2, C17H12.36, ucr-2.1, F40D4.13)的表达仍会显著降低,证实了它们为依赖lst-1和sygl-1的次级调控基因。
至此,很清晰了:GLP-1/Notch-LAG-1就是通过这2个基础靶基因,调控下游几十数百个基因的表达,从而控制生殖干细胞的发育的。
虽然没有找到新的,但为我们排除了幻想,避免在这个坑中浪费时间,意义重大。
这篇文章至少从两个层面给我们很好的启示:
- 你觉得一个转录因子应该调控多少个基因?你认为一个转录因子的Chip-seq,应该有多少个靶基因是正常的?其中又有多少是直接调控的?怎么获取直接调控的基因,也就是这里的基础靶基因?相信你读了这篇文章之后会有不错的收获。
- 文中值得一提的是sequential Chip-seq技术。这本来是一个研究蛋白复合物调控的技术,也就是首先对A蛋白IP,进而对A蛋白IP下来的产物对B蛋白进行第二轮IP,从而鉴定出A、B各自调控的对象,以及AB作为复合物调控的对象。作者在这里使用一个细胞特异的启动子启动的生物素连接酶在特定细胞中的特异表达,实现对目标蛋白在特定细胞中生物素化,然后使用sequential chip-seq,鉴定出生物素化的目标蛋白结合的DNA,也就是在特定细胞中结合的DNA。所以技术是死的,但灵活应用之后,会发挥意想不到的效果。



