m6A(N6-甲基腺嘌呤)是最常见、最丰富的真核生物mRNA转录后修饰形式之一。该修饰过程是动态可逆的,并由甲基转移酶复合体(METTL3,WTAP和METTL14组成)、去甲基酶(FTO和ALKBH5)和相应的阅读器(YTHDF或YTHDC等)协同调控。目前对于m6a修饰的研究主要与mRNA前体的剪接、调控mRNA翻译、影响mRNA的稳定性等相关,是生命科学的热门研究领域,今天就给大家带来一种全新的调控机制。
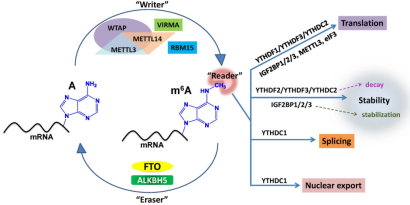
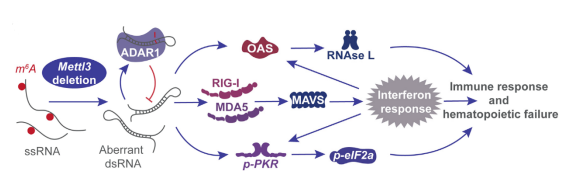
近期发表在Immunity杂志上的一篇文章发现:在小鼠胚胎发育时期通过敲除METTL3降低RNA的m6a修饰水平,会诱导RNA形成双链(dsRNA)构象,从而引发体内先天免疫信号转导异常,进而影响胎肝细胞中HSPC的增殖和分化,最终导致骨髓衰竭和胚胎死亡。
1.METTL3条件性缺失小鼠模型构建
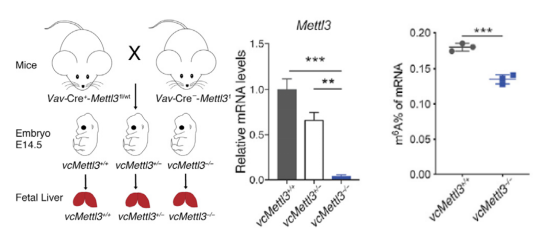
首先为了确认m6a修饰在小鼠造血过程中发挥的作用,作者开发了Vav-cre介导的METTL3基因敲除小鼠模型,Vav只在胎龄10.5-11.5的造血干细胞中开始表达,并在胎龄13.5-14.5时有效地缺失基因。使用METTL3杂合子小鼠和野生型小鼠杂交,分别产生了野生型、杂合(vcMettl3+/-)和METTL3双缺失小鼠(vcMettl3-/-) (下图左)。
-
qRT-PCR(下图中)和WB实验结果显示,vcMettl3-/-小鼠无METTL3基因的表达,证实METTL3敲除成功;
-
ELISA和meRIP-PCR实验证实,缺失METTL3显著降低了mRNA的m6a修饰水平(下图右);
-
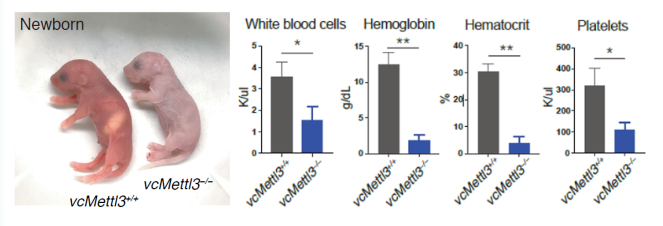
双缺失小鼠(vcMettl3-/-) 一般在胚胎发育晚期或围产期就已经死亡,而极少存活下来的vcMettl3-/-小鼠体积较小,外观苍白(下图左)。
-
在胚胎14.5日龄,三种小鼠胚胎和胎肝形态上无明显差异;但是与杂合子以及野生型的相比,vcMettl3-/-小鼠胎肝细胞总数明显减少(下图右);组织学切片结果显示成熟的类红细胞祖细胞减少;流式细胞仪也显示红细胞发育迟缓。
上述结果表明,METTL3的敲除,引起了m6A修饰水平的降低,引起造血相关细胞数目和种类减少最终导致小鼠造血系统障碍。
那么这个调控是通过什么途径实现的呢?由于METTL3敲除引起了造血相关细胞数目和种类减少,因此作者怀疑是造血干细胞的功能出现了异常。所以作者接下来对METTL3对造血干细胞的影响进行了研究。
作者检测了vcMettl3-/-小鼠的胎肝HSPCs在体外的增殖分化能力。结果显示:
-
CFU检测显示与野生型相比,vcMettl3-/-小鼠的HSPCs分化的各种类型均显著减少,并伴随有大小和形态异常(下图A,B);
-
通过逆转录病毒强制超表达METTL3能拯救vcMettl3-/-鼠胎肝HSPCs的分化能力。(下图C);
-
对受致死性辐照的同源小鼠进行细胞移植,植入vcMETTL3+/+胎肝细胞的小鼠得到拯救,但是移植vcMettl3-/-胎肝细胞的小鼠在2周内死亡(下图D);
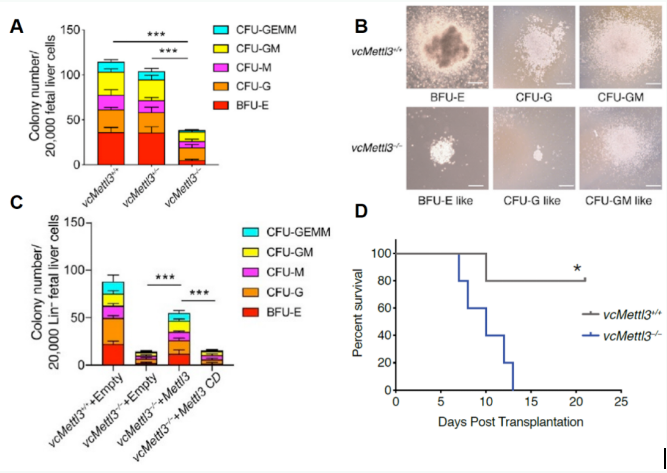
上述结果表明METTL3缺失的确导致了HSPCs的增殖、细胞系分化和成熟缺陷,进而导致造血功能衰竭。那么这个调控是如何发生的?作者进一步通过对不同小鼠胎肝中的HSPCLin_Sca-1+c-Kit+细胞(LSK)进行了RNA测序和单细胞RNA测序,对METTL3和m6A修饰对HSPC细胞的影响进行了研究。
-
单细胞测序结果表明,METTL3敲除前后,LSK细胞的组成没有发生变化(下图上左);
-
但RNA-seq和m6A-seq数据集均表明,在METTL3缺失时,LSK中上调表达的基因存在更高的m6A修饰水平(下图上右);
-
通路分析显示上调基因显著与抗病毒和干扰素反应密切相关(下图左下);
-
在这些基因中,OAS和ISG基因转录激活最为显著。METTL3缺失后,12个已知的OAS家族中有7个转录上调(下图右下)。
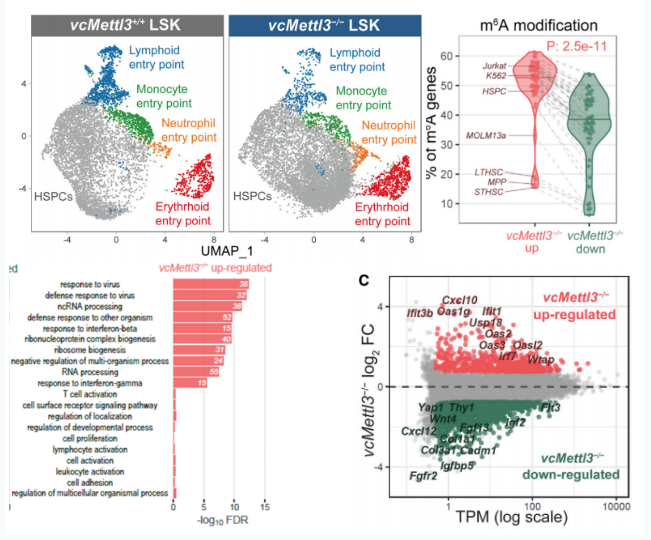
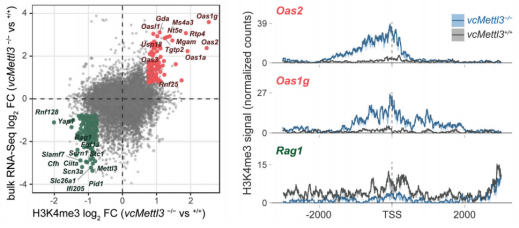
同时作者对52组人源和鼠源m6A-seq数据进行了分析,发现这些数据中,OAS基因本身通常没有m6a修饰,这说明METTL3和m6A修饰对OAS的调控,不是通过调控其RNA稳定性或者翻译机制实现的,因此作者猜测这些基因的高表达应该是被转录激活了。
作者使用CUT&RUN测序,对METTL3敲除前后H3K4me3的修饰(转录激活标志物)情况和上面RNAseq中的基因表达情况进行了联合分析,发现和OAS和ISG等基因在啊METTL3敲除后,H3K4me3水平大幅上升,说明这些基因的高表达是源于转录激活。
M6A修饰怎么和转录激活扯上关系?之前没有相关研究啊!!亲们,这种时候才是发挥大家聪明才智,抓大鱼的机会啊!!!
大部分病毒感染细胞后会产生dsRNA,机体检测到外源dsRNA会激发宿主先天性免疫应答,从而抑制病毒复制和感染。而OAS基因可以检测病毒dsRNA,并激活核糖核酸内切酶RNasel发挥抗病毒作用。
上面METTL3敲除后,细胞的表现和病毒感染好相似啊!!那么METTL3是否是通过调控RNA的m6a修饰水平,调控内源dsRNA形成,并最终调控先天性免疫反应的呢?
3.大胆假设,小心求证
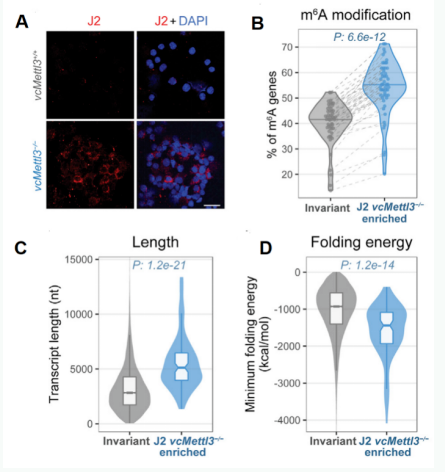
作者通过dsRNA特异性抗体J2对14.5胎龄小鼠进行FISH,检测METTL3敲除前后细胞内dsRNA的水平,发现METTL3敲除后,小鼠的胎肝细胞中出现大量dsRNA累积(下图A):
-
作者进一步使用J2抗体进行RIP-seq,对是哪些RNA参与形成了双链结构进行了鉴定,并对这些参与双链形成的RNA的m6A修饰水平进行了联合分析,发现这些dsRNA的m6a修饰程度更高(下图B);
-
这些参与双链形成的RNA长度较长(下图C),并且具有更低的折叠能(下图D),因此可能在m6a修饰稳定了其单链结构,m6A修饰消失之后倾向采用dsRNA结构。
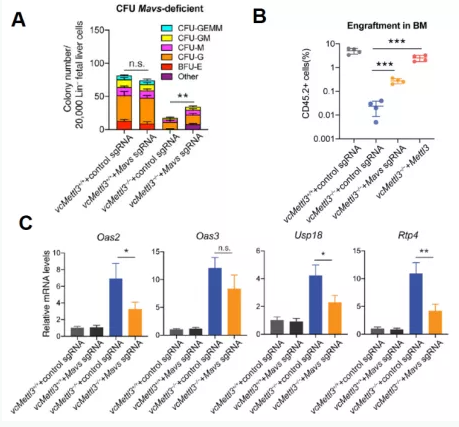
上述结果证明了m6A修饰通过调控RNA双链形成,调控了机体的天然免疫反应。那么天然免疫又是如何和造血功能联系到一起的呢?因为大部分模式识别受体相关的先天性免疫反应都集中在MAVS介导的IFN信号通路上,所以作者通过CRISPR-Cas9的敲除MAVs,并检测了敲除前后对HSPC功能的影响:
-
缺失MAVs能拯救vcMettl3-/-小鼠胎肝HSPCs的分化能力(下图A);
-
缺失MAVs能抑制OAS基因家族的激活(下图B),抑制RNaseL活性(下图C)。
至此,绕了一大圈,终于将这个环给接上了,感觉真是酣畅淋漓、行云流水。下面就是这个生物学过程中的机制:m6A修饰稳定RNA的单链结构,缺失后诱导大量内源性dsRNA的形成,这些dsRNA激活了机体的先天免疫应,最终导致HSPC的增殖和分化异常,导致骨髓衰竭和胚胎死亡。
参考文献:
Gao Y, Vasic R, Song Y, et al. m6A Modification Prevents Formation of Endogenous Double-Stranded RNAs and Deleterious Innate Immune Responses during Hematopoietic Development. Immunity. 2020;52(6):1007-1021.e8.



