转录调控是真核生物中最重要的调控模式之一,其中的核心就是转录因子了,转录因子公认的调控模式是通过结合到基因的启动子区或远端的增强子区,调控基因转录。但是有一些转录因子却不走寻常路,不在这些位置结合,反而跑到基因内部结合。这些结合是怎么调控的,又该怎么研究呢?今天我们就通过一篇Nature Plant上的文章,一起来长长见识。
1. 研究对象:TEN在黄瓜卷须形成中的作用
在黄瓜生产中,培育黄瓜的无卷须品种是黄瓜株型改良的一个重要方向。本文作者在2015年发现了控制卷须的基因TEN(转录因子 CYC/TB1家族成员)。该研究中发现TEN的C端单点突变体ten-1(N338Y)会导致黄瓜生成侧枝而不是卷须。
在本研究中,作者进一步构建了TEN的缺失突变体ten-2和缺失N端前120个氨基酸的截短突变体ten-3和ten-4,并研究了相应的表型,发现:
-
ten-2和ten-1表型一致,卷须完全变为侧枝(下图c,d,g);
-
ten-3和ten-4则和野生型差异不大,但是在其卷须上产生腋生分生组织,并且其攀援能力明显变弱(下图e,f,g)。
这些些结果表明,N端和C端对TEN的功能都是至关重要的。

作为一个转录因子,对其机制研究的第一步肯定就是找到其调控的靶基因有哪些,又是哪些靶基因/通路决定了表型。因此为了更好的阐述TEN在卷须形成中的作用机制,作者对TEN进行了Chip-seq。
2. TEN通过识别CDCCRCC结合到基因内部
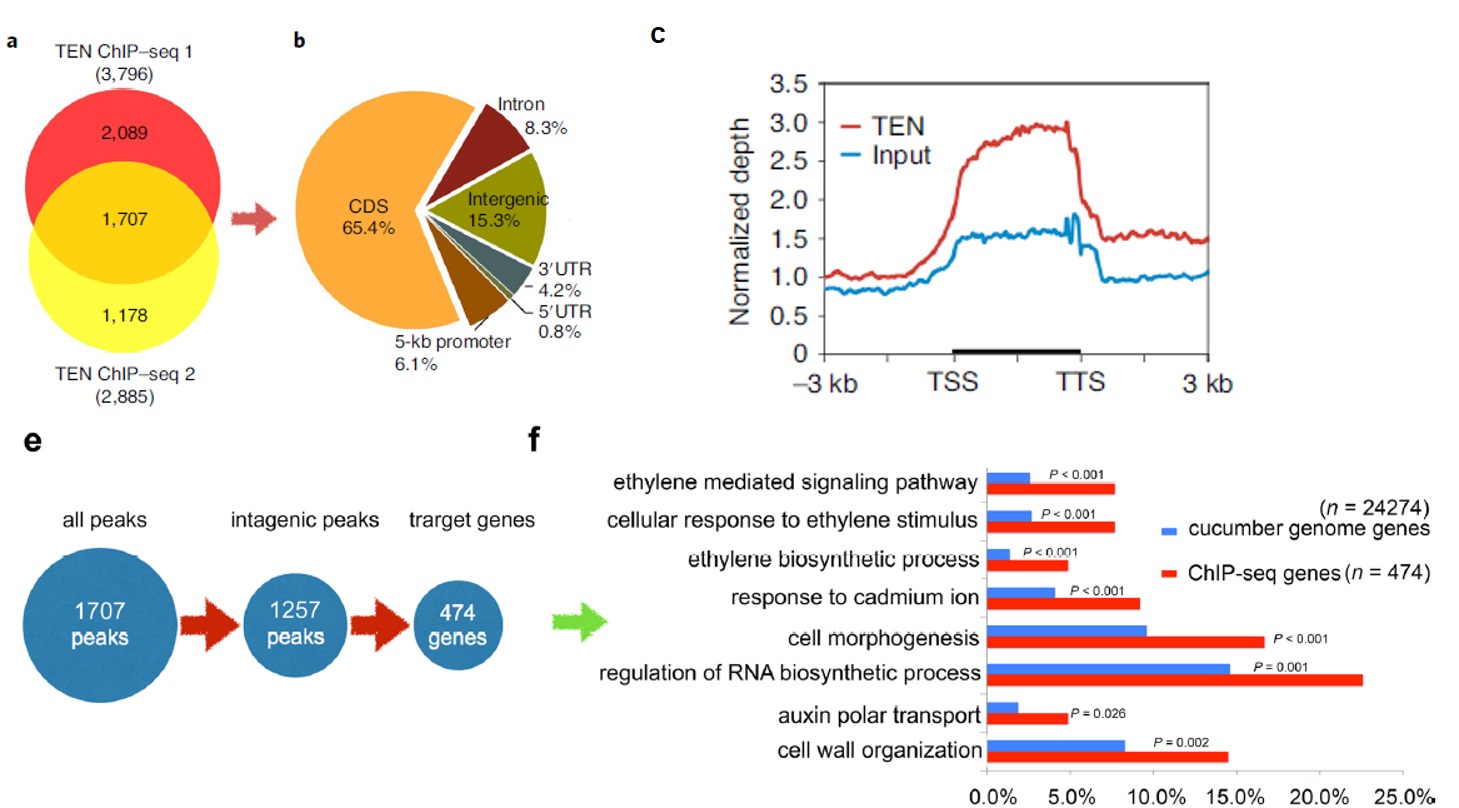
Chip-seq结果如下图,作者通过两次生物学重复共有鉴定到1707个overlap peak作为TEN的结合位点(下图a,这个overlap的比例有点感人啊^_^,知识点:一定要做重复啊)。
奇特的是,这些peak在TSS没有任何富集,绝大部分结合到了基因内部(图b-e)。这些peak分布在474个基因上,功能富集分析发现这些基因主要涉及腋芽发育、乙烯合成等通路(图f)。
对Chip-seq中基因内的peaks进行分析,发现一个显著的motif:CDCCRCC(下图k)。那么TEN基因哪个区域能与这个motif结合呢?
作者利用Sf9昆虫细胞表达纯化了一系列截短的TEN蛋白(下图i),利用EMSA实验分析了TEN对这个motif的结合模式:
-
发现N端缺失不影响TEN对该motif的结合(下图n);
-
C端的缺失(MBP-TCP、MBP-TCP+R)和突变(N338Y)使蛋白丧失了结合能力(下图m、o)。
上述结果表明TEN是通过其C端识别基因内的CDCCRCC motif。

作者还对TEN突变(N338Y)前后,上述474个结合在基因内部的靶基因的表达变化进行了RNA-seq检测,发现突变体中有132个基因显著下调,并且没有显著上调的基因。经常关注我们公众号的同学们应该很熟悉了,这是转录因子靶基因鉴定的经典手段~~
上面的结果很solid,但是不是和我们对TF的理解不大一样?为什么不结合在启动子区呢?在基因内结合,其调控是怎么完成的呢?其实CYC/TB1类的转录因子在前期的研究中就被发现结合到基因的内部来激活目标基因,但机制一直没有搞清楚。因此作者就准备给我们揭开这个谜团了。怎么做呢?找一个/几个靶基因进行机制研究呗。
3. 基因内CDCCRCC motif是一类新的enhancer
选谁呢?Chip-seq结果表明TEN结合的基因与乙烯合成相关,而乙烯已经被报道可诱导卷须自发卷曲,因此作者选择了乙烯生物合成途径的2个靶基因ACO1和ERF1(乙烯生物合成中的标志性基因)展开了研究。
作者首先通过Chip-PCR验证了TEN对这些基因的结合是存在的,进而通过构建突变体证明了ACO1在卷须攀附中的作用(结果见原文)。接下来作者就对TEN调控ACO1的机制进行了深入的研究:
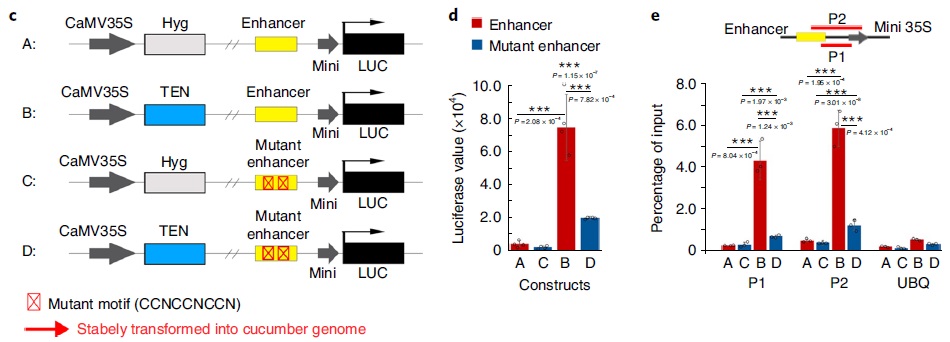
这些基因内部都存在CDCCRCC motif,这些motif可能发挥着增强子的功能,招募TEN激活基因的表达。因此作者设计了dual-Luciferase报告系统(图c),检测这些潜在的增强子对基因表达的激活作用,以及对TEN的依赖性,发现:
-
Enhancer本身不能激活基因的表达(图c/d中A);
-
表达TEN之后,基因的表达被激活了40倍(图c/d中B);
-
将Enhancer突变之后表达TEN,基因的激活程度大幅降低;
-
使用稳定表达TEN+增强子的植物叶片进行Chip-PCR实验,发现TEN能够结合enhancer,而enhancer突变之后,TEN结合强度显著减弱(图e)。
这些结果说明,CDCCRCC是未被报道的基因内的增强子新类型,TEN C端能特异性结合该增强子以此影响基因的表达。
4. TEN通过调控组蛋白乙酰化激活基因表达
以上结果证实TEN C端能与基因内增强子结合,但结合之后为什么能激活基因的表达呢?作者通过PSI-BLAST分析,发现TEN N端区域与拟南芥HXXXD酰基转移酶有一定的相似性,作者推测TEN可能有组蛋白乙酰转移酶(HAT)活性。为了证实这一猜测,作者对TEN蛋白的乙酰化转移酶活性进行了鉴定:
-
TEN和经典的HAT P300一样都可以乙酰化组蛋白H3,但活性较P300稍低,且修饰的偏好性不同:TEN对H3-H4四聚体和完整核小体(八聚体)中的H3具有更高的活性(图a)。
-
通过质谱发现,组蛋白H3的尾部区域K23和K36,球状区域K56、K79和K122都可以被乙酰化,球状区氨基酸乙酰化水平更高(下图d);
-
完整的TEN、C端突变(N338Y) 和N端(N121)均能乙酰化组蛋白H3,而N端缺失突变体(TENΔN121)则丧失了催化能力,说明催化是蛋白N端的功能(图c);
-
在烟草叶片中瞬时表达TEN会增加H3K56和H3K122的乙酰化程度(下图h);
通过CHIP-seq对体内H3K56ac和H3K122ac的水平进行检测发现,基因内(外显子和内含子)H3K56ac和H3K122ac的修饰频率10倍高于启动子区和基因间区(下图k),这和TEN在基因上的结合模式是一致的。
上述结果确认了TEN的N端结构域是一种组蛋白乙酰基转移酶,它优先对完整核小体中的H3K56和K122进行乙酰化修饰。Ten通过C端对基因内部CDCCRCC enhancer的识别,结合到基因gene body上,催化H3K56ac和H3K122ac的发生。

5. TEN介导的乙酰化修饰影响染色质开放程度
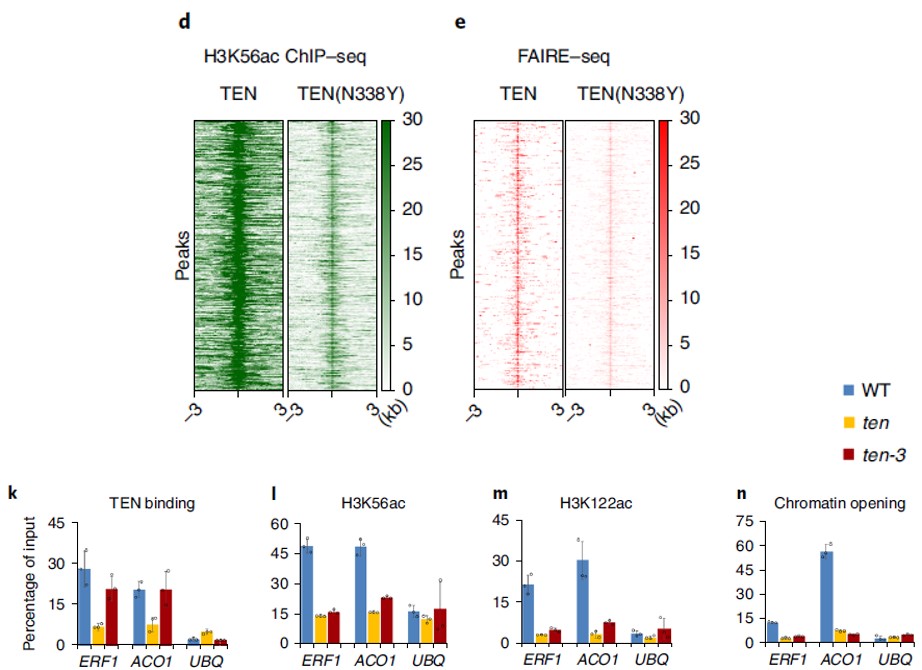
乙酰化修饰是活跃表达基因需要的修饰类型,通常会影响染色质的开放程度。因此作者通过FAIRE-seq(一种类似于ATAC-seq的技术)来确定TEN结合引起的染色质开放程度变化,结果发现:
-
TEN的C端突变后(N338Y),DNA结合能力的确大幅下降(图d),伴随的是染色质开放程度的显著降低(图e);
-
通过Chip-PCR对TEN结合、H3K56/122ac和染色质开放程度之间的联系在2个靶基因上进行验证发现:C端突变(黄色)影响了TEN对靶基因的结合,N端突变(红色)不影响TEN对靶基因的结合,但无论是C端还是N端突变都显著影响了靶基因H3K56/122的乙酰化水平和染色质开放程度(图k-n),但对非靶基因则无影响(UBQ)。
至此全文结束,形成最终的调控模式:
-
TEN的C端具有DNA结合活性,识别基因内部的CDCCRCC enhancer;
-
TEN的N端具有乙酰化转移酶的活性,对H3K56/122进行乙酰化修饰;
-
上述两个活性结合起来,使得TEN定位到靶基因gene body,催化H3K56/122ac;
-
乙酰化修饰使得基因区域染色质开放程度增加,从而激活基因表达。
这项工作非常漂亮,通过Chip-seq和RNA-seq联合鉴定出靶基因,包括Luciferase验证都是套路的工作。神来之笔是预测出TEN的N端具备乙酰化转移酶活性,这的确需要非常跳跃的思维,而从乙酰化修饰做到染色质开放程度,则需要扎实的知识储备。赞!!
参考文献:
Yang, X., Yan, J., Zhang, Z. et al. Regulation of plant architecture by a new histone acetyltransferase targeting gene bodies. Nat. Plants 6, 809–822 (2020). https://doi.org/10.1038/s41477-020-0715-2



