组蛋白修饰中,H3K27me3修饰作为转录抑制标志被大家所熟知,但其调控转录的详细机制尚不完全清楚。这篇近期发表在Nature Communication上的文章报道,含BAH结构域蛋白AIPP3和含PHD结构域蛋白AIPP2/PAIPP2协同识别拟南芥中的H3K27me3和未修饰的H3K4组蛋白,同时,该BAH-PHD还与磷酸酶CPL2形成复合体(BAH-PHD-CPL2 complex,BPC),通过对Pol II去磷酸化,阻碍Pol II从转录起始位点释放,从而抑制基因转录。本文首次将组蛋白修饰与Pol II去磷酸化关联了起来,下面就来跟小编一起,围观作者解析这个表观调控机制的思路和方法吧。


研究背景和待解决的科学问题
真核生物中,组蛋白修饰H3K27me3作为常染色质中的广泛存在的抑制性表观遗传标记,在多种生命过程中发挥了重要作用,但其抑制转录的机制还未完全揭示清楚。有研究表明,含BAH结构域的蛋白和PHD结构域的蛋白能够各自分别结合多种修饰组蛋白,但在植物中,这两类蛋白是否参与识别组蛋白修饰,是否介导了转录抑制,目前还没有报道。
因此,本文想要解决的科学问题,就是想研究含BAH结构域的蛋白AIPP3和含PHD结构域的蛋白AIPP2/PAIPP2蛋白是否识别组蛋白修饰,以及是否介导了下游基因的转录抑制。如果的确介导了转录抑制,其机制又是什么?
研究思路解析
1. BAH-PHD-CPL2以复合物形式调控了基因表达,影响拟南芥开花
免疫沉淀质谱和酵母双杂技术验证复合体成员之间的结合作用。结果表明PHD结构域蛋白AIPP2/PAIPP2蛋白各自独立与AIPP3和CPL2形成复合体,但AIPP2和PAIPP2蛋白之间无相互作用(下图a、b、c)。


前期研究表明,开花抑制基因FLC和开花促进基因FT上的H3K27me3修饰对开花的时间有显著调控。因此,作者构建了BPC中的单体单突变体(aipp2-1、paipp2-1、aipp3-1、cpl2-2)及多体突变体(aipp2-1/paipp2-1、aipp3-1/aipp2-1/paipp2-1、cpl2-2/aipp2-1/paipp2-1、aipp3-1/cpl2-2),来研究BPC参与调控的开花情况。
结果表明,BPC突变体aipp3-1、cpl2-2、aipp2-1/paipp2-1发生多种严重发育缺陷,如矮柱、叶小和不育等,表明该复合体对于植物的正常发育是必须的。不过,aipp2-1和paipp2-1突变体发育缺陷不严重(见下图a)。


与野生型Col-0相比,不论是长日(long day,LD)还是短日(short day,SD)光周期,aipp3-1和cpl2-2突变体在明显较早开花。aipp2-1和paipp2-1突变体的开花时间与Col-0差异较小,但aipp2-1/paipp2-1双突变体的开花时间与aipp3-1和cpl2-1类似(见下图b、c),表明AIPP2和PAIPP2这两种PHD蛋白存在冗余性。


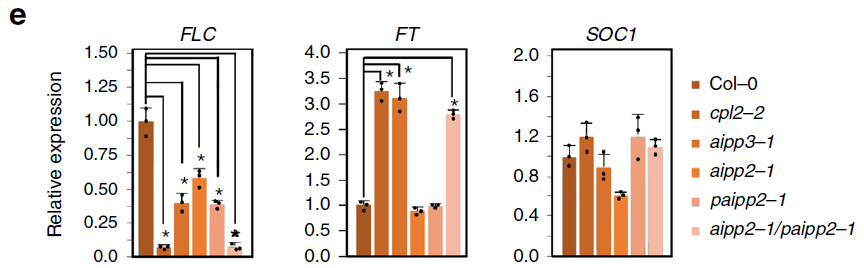
抑制因子FLC通过结合开花促进基因FT和SOC1来抑制开花。RT-qPCR实验表明,FLC RNA表达量在aipp2-1、paipp2-1、aipp3-1、cpl2-2和aipp2-1/paipp2-1这些突变体中均下调,FT在aipp3-1、cpl2-2和aipp2-1/paipp2-1表达上调,但在aipp2-1和paipp2-1未上调,进一步表明AIPP2和PAIPP2存在冗余。但SOC1表达量在突变体中未见显著变化(见下图e)。

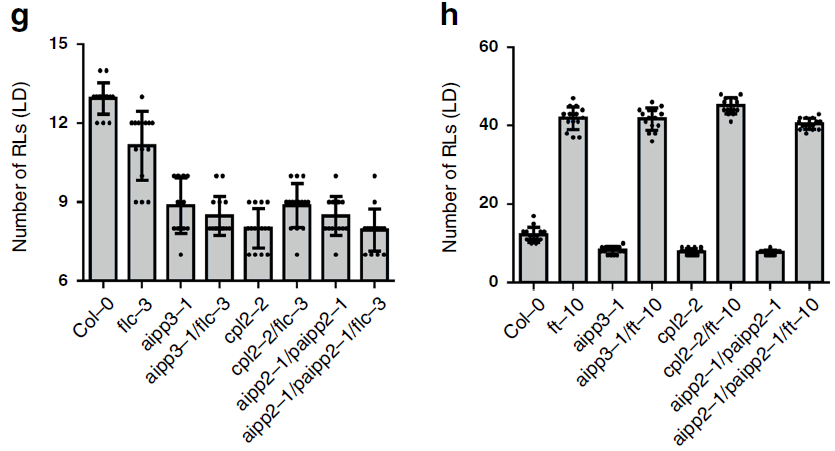
为了进一步弄清楚FLC和FT与BPC的关系,在BPC突变体的基础上,作者进一步构建了FLC和FT的突变体,发现以开花时间论,aipp3-1/flc-3、cpl2-2/flc-3和aipp2-1/paipp2-1/flc-3与aipp3-1、cpl2-1和aipp2/paipp2的表型相近,都比单突变体flc-3提前了更多(下图e)。与之形成强烈对比的是,FT突变ft-10挽救了BPC突变体的提前开花表型,推后了开花时间(下图h)。

以上结果表明,BPC主要通过抑制FT基因的表达来抑制开花。
2. BPC复合体与修饰组蛋白的结合
确认了BPC调控FT之后,由于前期研究已证实BHA和PHD结构域能识别组蛋白修饰,那么BPC调控基因表达是否与组蛋白修饰有关?作者检测了BPC组成蛋白与多种修饰组蛋白的结合能力:
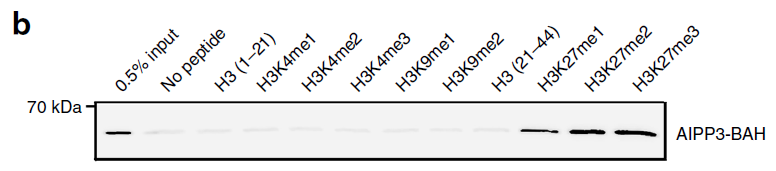
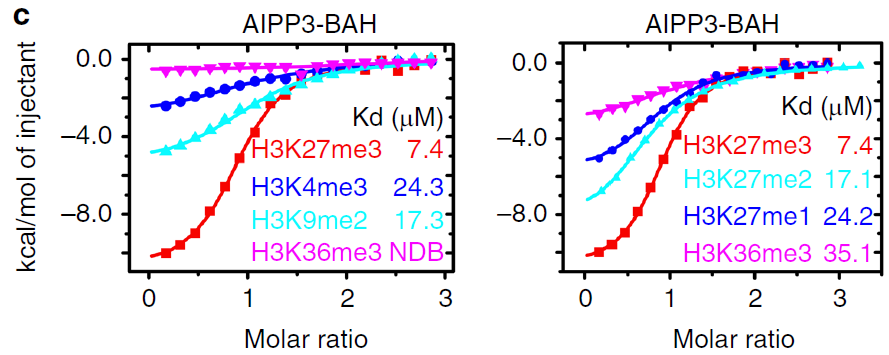
pull-down实验表明,AIPP3-BAH可以特异性结合H3K37me1/2/3(见下图b),等温滴定量热(isothermal titration calorimetry,ITC)确认AIPP3-BAH与H3K27me3结合能力最强(见下图c)。


ITC表明PAIPP2特异性结合未修饰的H3K4(见下图i)。
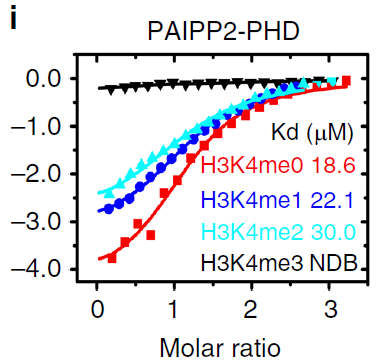

上述实验表明,BPC具备识别H3K27me3/H3K4组蛋白的能力,可能通过识别组蛋白修饰,介导了基因的转录调控。
3. BPC通过H3K27me3/H3K4介导基因表达调控
作者先检测了BPC突变对基因表达的影响,研究受影响的基因上组蛋白修饰的特点。为了对比,作者还构建了H3K27me3的甲基转移酶CLF突变体clf-81,以及H3K27me3 reader蛋白LHP1突变体lhp1-3。
野生型和BPC突变体的RNA-seq数据显示,除aipp2-1和paipp2-1之外,突变体大量基因表达上调(远多于下调基因),表明BPC是一个转录抑制复合体(见下图a)。
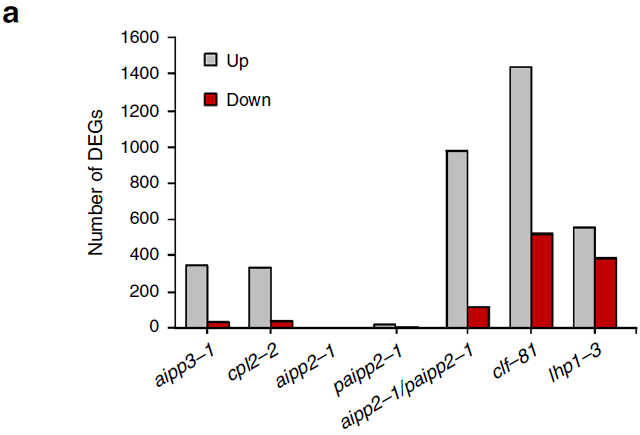

ChIP-seq数据表明,H3K27me3显著富集于突变体上调基因(见下图e),而H3K4me3在这些基因的TSS区域未见明显富集。


ChIP-qPCR和ChIP-seq显示,突变体中显著上调的BPC典型靶基因上富集了AIPP3、AIPP2和PAIPP2蛋白(见下图a、b)。在全基因组范围,AIPP3的结合峰也富集于aipp3-1突变体显著上调的基因上(见下图c、d)


在AIPP3结合的基因中,能清楚地观察到高H3K27me3和低H3K4me3的分布模式(见下图e)。


为了进一步证明结合H3K27me3组蛋白是BPC调控开花基因表达的必要条件,作者构建了突变体,破坏了AIPP3-BAH与H3K27me3的结合能力,研究开花表型。
ChIP-qPCR表明,W170A突变削弱了AIPP3与BPC典型靶基因的结合(见下图e)。
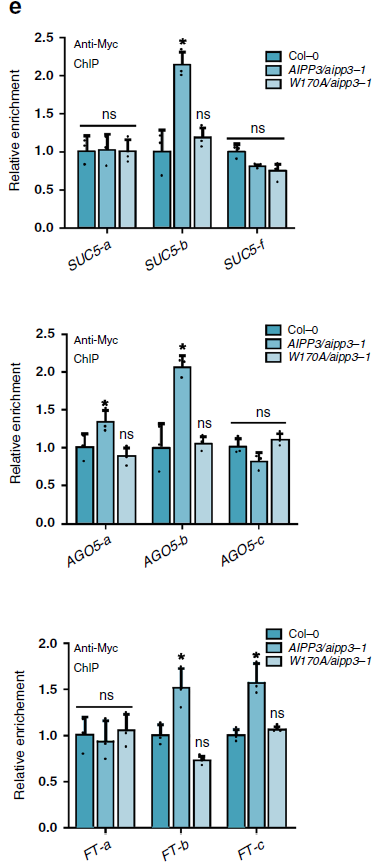

AIPP3-BAH结合位点突变体W170A和Y149A/W170A/Y172A表现出与敲低突变体aipp3-1一样的早花表型(见下图a、b)


RT-qPCR表明,AIPP3能挽救突变体aipp3-1的表达变化,但W170A突变无法挽救(见下图d)。
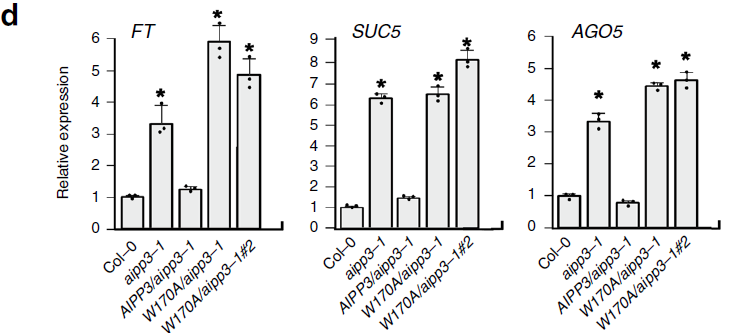

以上结果表明,AIPP-BAH对H3K27me3的结合是调控靶标基因的必要条件。
4. BPC识别组蛋白修饰与Pol II磷酸化偶联
以上解析了BPC识别H3K27me3标记基因,调控其表达,但具体的转录调控机制是怎么样的?前期研究表明,在转录过程中,Pol II首先在启动子区域组装。转录开始后,Pol II Ser5和Ser2处被磷酸化,然后从近端启动子区域释放,继续RNA延伸。CPL2能在Ser5处脱磷酸化,因此,作者假设BAH和PHD识别H3K27me3和未修饰的H3K4,介导CPL2对Pol II去磷酸化,从而抑制转录。
作者对BPC靶基因转录起始位点的Pol II磷酸化水平进行了分析:
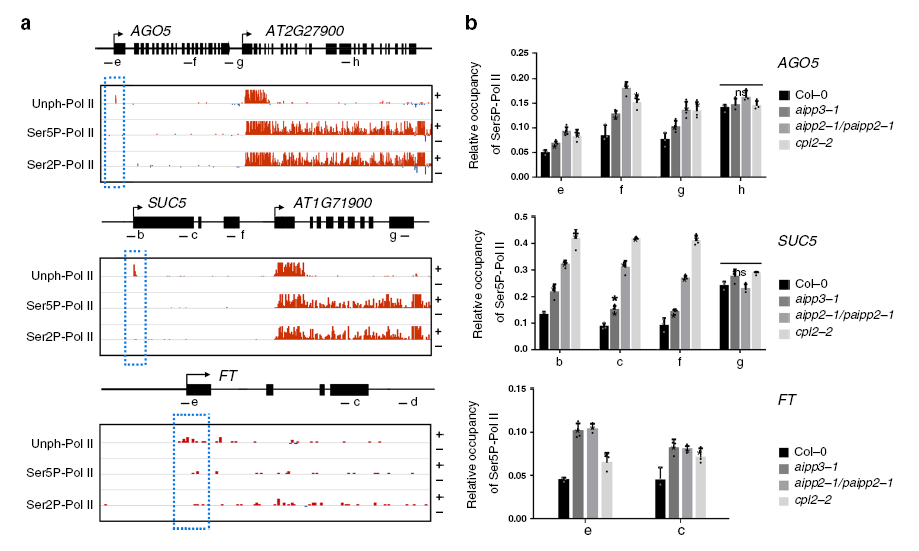
BPC典型靶基因(AGO5、SUC5和FT)转录起始位点富含末端未磷酸化的Pol II,而Ser5P-Pol II和Ser2P-Pol II的水平很低(见下图a);
BPC突变体中,典型靶基因转录起始位点富集的Ser5P-Pol II和Ser2P-Pol II水平显著上调(见下图b)。

作者构建了CPL2-GFP/Col-0,CPL2-GFP/aipp3-1和CPL2-GFP/aipp2-1/paipp2-1植株,ChIP qPCR证明,CPL2-GFP/Col-0结合BCP靶基因,但aipp3-1和aipp2-1/paipp2-1完全不结合这些基因。
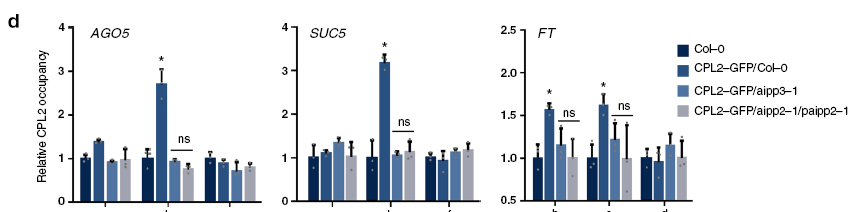

以上结果表明,CPL2对BPC靶基因的结合依赖于BAH和PHD蛋白。
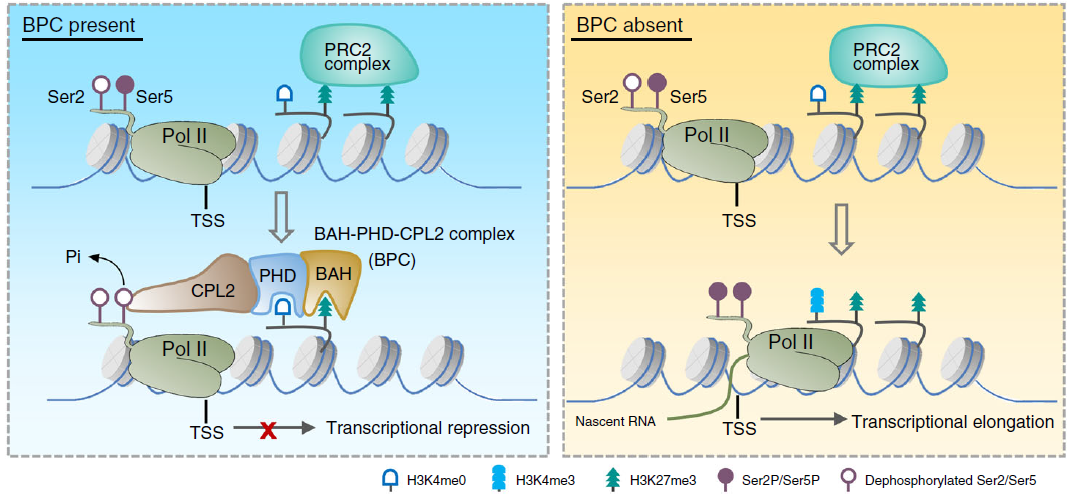
上述实验揭示了BPC识别H3K27me3靶基因对CPL2的招募过程,将靶基因转录起始位点的Pol II的磷酸化水平及转录效率与BPC识别H3K27me3相偶联,揭示BPC转录抑制调控机制(见下图)。

总结
本文首次将H3K27me3的识别直接与Pol II CTD的磷酸化调控相偶联,作者在证明BPC作为组蛋白修饰reader调控转录的思路和方法上是非常出彩的。最后我们再一起回顾下这篇文章的研究思路吧:
- 通过免疫沉淀质谱和酵母双杂证明了BAH-PHD-CPL2复合物成员之间的结合。BPC突变体表现及遗传学研究确认BPC复合体通过转录抑制调控关键生理过程。
- 通过pull down和ITC确定BPC结合的组蛋白修饰为H3K27me/H3K4me0。
- 通过RNA-seq及ChIP seq数据分析表明BPC转录抑制调控基因富集了H3K27me3修饰。
- 验证BPC与H3K27me3的结合是调控靶基因表达及相关生理表型的必要条件。
- 证明了BPC对H3K27me3靶基因的表达调控与CPL2介导的Pol II 的磷酸化转录调控相偶联。
文章思路层层推进,选择实验的目的非常清楚,最终揭示BPC介导的H3K27me3抑制转录分子机制,工作扎实、漂亮,值得广大机制研究者揣摩和借鉴。
参考文献:Zhang YZ,et al. Coupling of H3K27me3 recognition with transcriptional repression through the BAH-PHD-CPL2 complex in Arabidopsis. Nature Communications(2020).



