
研究背景
鼻咽癌是我国高发恶性肿瘤之一,发病率为耳鼻咽喉恶性肿瘤之首。放疗联合化疗是局部晚期鼻咽癌(nasopharyngeal carcinoma, NPC)的主要治疗策略。然而,远端转移和耐药性仍然局限了治疗方案,成为导致NPC患者死亡的主要原因。目前的肿瘤转移分期系统还不能够有效预测NPC患者是否适合化疗,迫切需要探索新的生物标志物来确定治疗方法。
circRNA为闭合环状结构RNA,不易受到RNA外切酶的影响,因此不易降解,表达更稳定,且具有组织表达特异性,这使得circRNA在成为癌症诊断、预后以及治疗靶标的生物标志物的开发和应用方面具有明显优势,近年来circRNA充当ceRNA机制中miRNA海绵的研究也相当火热。目前circRNA在鼻咽癌(NPC)中的功能和机制尚需阐明。本研究通过circRNA-seq锚定目标circRNA,再通过一系列生物学手段进行机制探究,思路清晰严谨,验证方法多样,故事环环相扣,从体外细胞实验到体内动物模型实验,再到临床检验预后模型构建,堪称ceRNA研究的典范。快来跟小编一起一睹为快吧。
研究思路
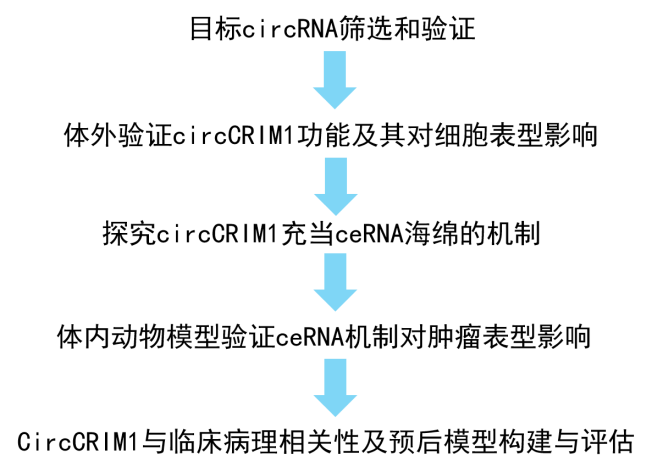
研究过程
目标circRNA的筛选与验证
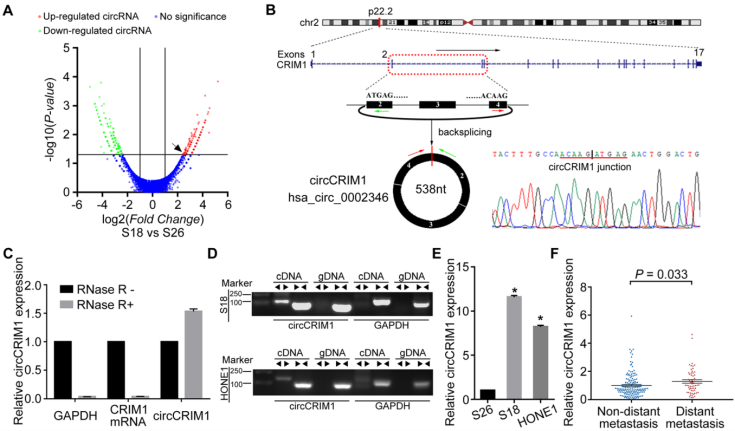
作者首先对高转移潜能鼻咽癌细胞系(S18)和低转移潜能鼻咽癌细胞系(S26)的circRNA测序,筛选出S18中上调显著的circRNA作为潜在对象(下图 A)。作者挑选了上调最显著的环状RNA之一circCRIM1继续研究。通过一代测序(下图B)、Rnase R处理(下图C)以及cDNA/gDNA PCR(下图D)等手段验证目标circRNA的环状结构。再通过检测其在不同细胞系中的表达量(下图E)以及在远端转移和无转移NPC患者中的表达量(下图F),证实circCRIM1在远端转移NPC患者中高表达。
体外表型验证
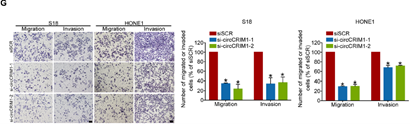
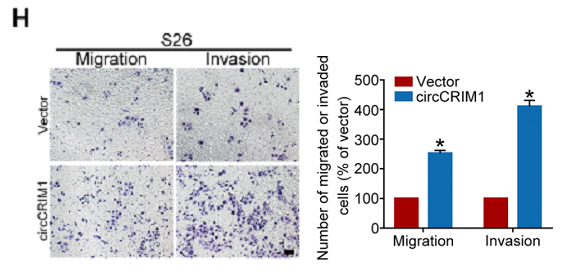
首先,作者研究了circCRIM1对NPC细胞迁移、侵袭能力的影响。作者通过敲除和过表达circCRIM1后的Transwell实验分析证实,敲低circCRIM1表达可显著抑制S18和HONE1细胞的迁移和侵袭能力(下图G),过表达则可以明显促进S26细胞的迁移和侵袭(下图H)。
同时,作者发现CircCRIM1促进鼻咽癌上皮间充质转化(EMT)(下图I和J),而EMT是肿瘤细胞获得迁移和侵袭能力的重要生物学过程,再次补充证明了circCRIM1能促进NPC细胞的迁移、侵袭。
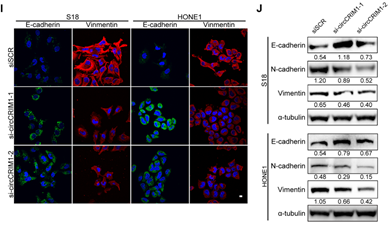
至此,以上结果表明,circCRIM1与NPC细胞的迁移和侵袭能力正相关。于是作者着手进行circCRIM1的调节机制探究。
调节机制探究
为了观察circCRIM1的细胞分布,作者对核和细胞质circCRIM1 RNA进行了RT-qPCR和FISH分析。结果表明circCRIM1转录本主要位于细胞质(下图和A和B)。
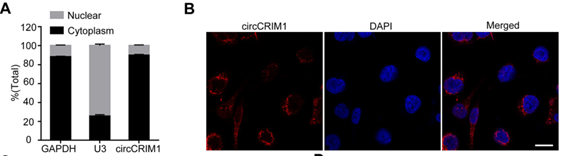
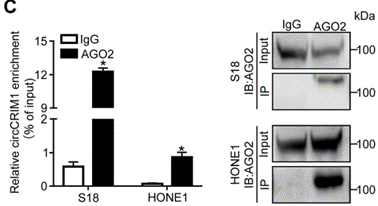
鉴于circCRIM1在细胞质中富集,作者进一步通过RIP实验探索circCRIM1是否在鼻咽癌的致病过程中充当ceRNA。结果表明,AGO2抗体可显著富集circCRIM1(下图C),由于miRNA通过AGO2发挥作用,提示circCRIM1可能与miRNA结合。
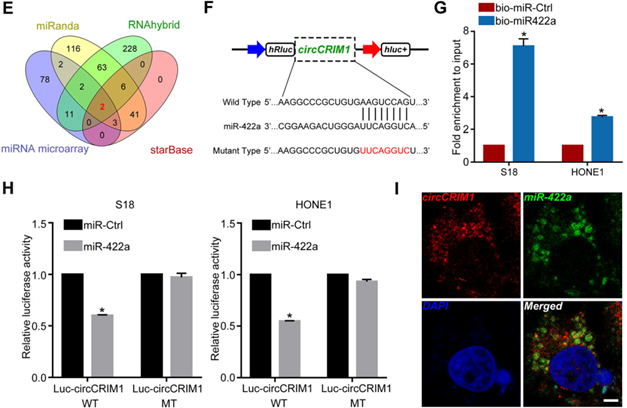
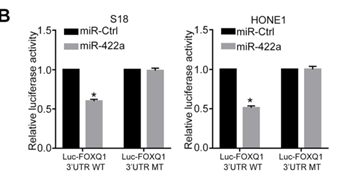
为了确定与circCRIM1相互作用的miRNA,作者接下来进行了微阵列实验,对S18细胞 vs S26细胞中下调的miRNA进行生物信息学分析预测,最终发现miR-422a和miR-4436a包含circCRIM1区域的潜在靶向位点(下图E-F)。之后通过荧光素酶测定验证发现异位miR-422a表达显著降低circCRIM1野生型报告分子的荧光素酶活性(下图G),随后,又通过FISH实验表明circCRIM1和miR-422a在NPC细胞中共定位(下图I)。以上表明circCRIM1可以直接结合miR-422a发挥作用。
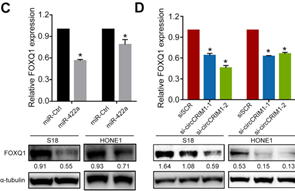
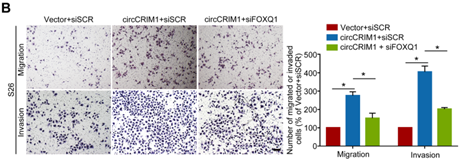
那么circCRIM1和miR-422a作用的下游的靶标mRNA又是哪个呢?作者先采用miRDB数据库预测得到FOXQ1是miR-422a的可能靶基因。后续通过构建荧光素酶报告载体,检测miR-422a显著影响FOXQ1 3'UTR报告基因的荧光素酶活性(图B)。而RT-qPCR和Western blotting分析也显示miR-422a过表达能显著降低FOXQ1 mRNA和蛋白质水平,而且,circCRIM1敲除显著抑制FOXQ1表达(图C-D)。
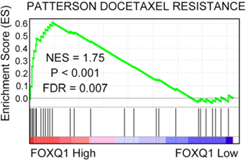
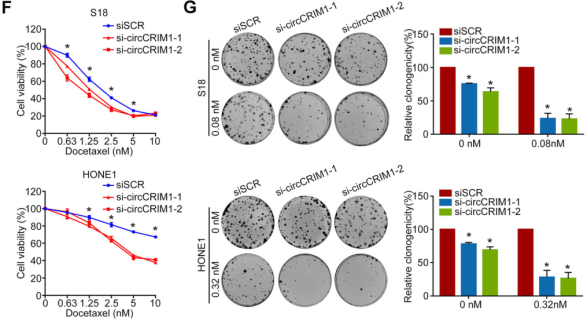
接着,作者又通过对NPC患者多西紫杉醇耐药性相关基因做了GSEA分析,以及研究了circCRIM1对NPC细胞多西紫杉醇的敏感性的影响,结果共同表明,FOXQ1能影响NPC的耐药性,且与circCRIM1对多西紫杉醇治疗 NPC 细胞转移产生的影响一致(下图E-G)。
以上结果表明,circCRIM1 和miR-422a 都能对FOXQ1起调控作用。那么它们是通过什么样的方式来调控FOXQ1呢?
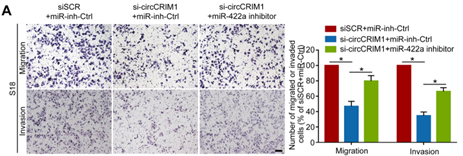
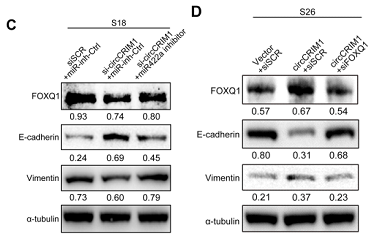
作者假设circCRIM1 通过miR-422a 来调控FOXQ1,并对这一假设进行了验证。首先用miR-422a抑制剂来降低S18细胞中miR-422a的表达,之后通过Transwell实验,证实了抑制miR-422a可以挽救circCRIM1下调对NPC细胞迁移和侵袭能力的抑制作用(下图A)。此外,上皮标记物表达下调和间充质标记物表达上调证明,抑制miR-422a能显著降低circCRIM1下调诱导的FOXQ1高表达和EMT受抑(下图C)。同时,敲低FOXQ1能很大程度上挽救circCRIM1过表达引起的NPC细胞迁移和侵袭的增强(下图B)。抑制FOXQ1表达显著逆转了过表达circCRIM1诱导的NPC细胞EMT程度(下图D)。综上所述,这些结果表明,circCRIM1通过ceRNA机制充当miR-422a的海绵调节FOXQ1表达,促进NPC细胞转移和EMT过程。
体内模型验证
明确了circCRIM1 --> miR-422a --> FOXQ1的ceRNA机制之后,作者利用一系列小鼠模型,在体内验证circCRIM1对NPC转移的影响。
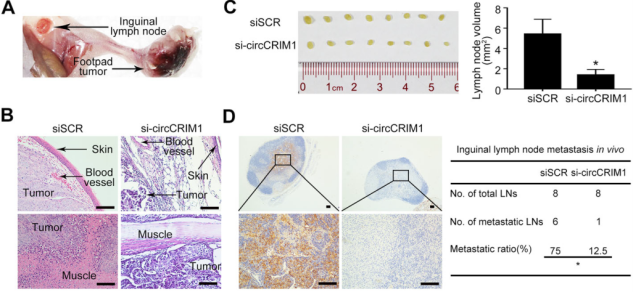
一方面,作者将S18细胞移植到裸鼠的脚垫中,构建腹股沟淋巴结转移模型,并定期局部注射胆固醇偶联的circCRIM1的siRNA (下图A)。四周后的H&E染色表明,circCRIM1敲低组的足垫肿瘤表现出侵袭性较弱的表型,仅侵袭皮肤和肌肉(下图B),且circCRIM1下调显著降低了转移性腹股沟淋巴结的数量和比例,以及泛细胞角蛋白阳性肿瘤细胞的数量(下图C-D).
另一方面,作者将S18细胞接种到小鼠的尾静脉中(每组n = 5),构建肺转移定植模型,同样通过尾静脉注射胆固醇偶联的circCRIM1的siRNA。五周后发现,敲低circCRIM1导致小鼠体内肺转移结节明显减少(下图E),且肺部转移性肿瘤结节更小(下图F)。值得注意的是,在circCRIM1敲低组的肺转移性结节中,发现了FOXQ1与circCRIM1保持一致低水平表达(下图G)。
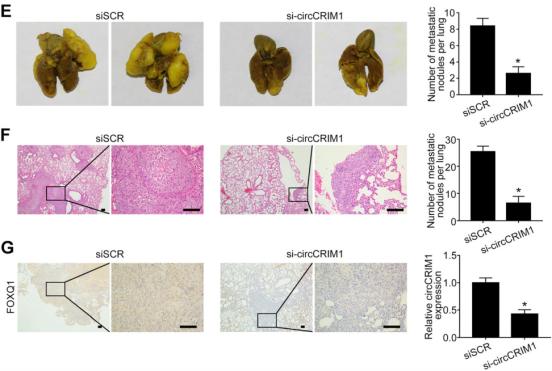
临床价值评估
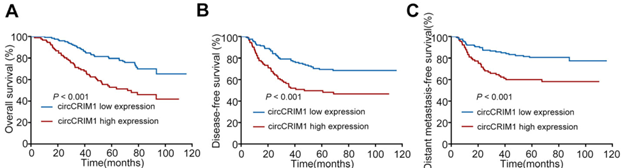
小鼠模型验证之后,作者对circCRIM1功效进行了临床价值评估。通过RT-qPCR检测了218位NPC患者组织中circCRIM1的表达。统计学分析表明,circCRIM1表达水平与患者总生存期(OS),无病生存期(DFS)和远端无转移生存期(DMFS)呈负相关(下图A-C)。因此,circCRIM1表达在临床上与NPC患者预后结果相关。
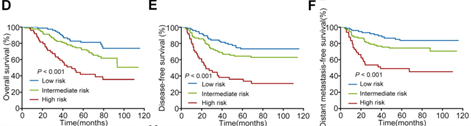
另外,作者结合circCRIM1表达情况和淋巴结分期,将具有远端转移风险的患者分为低(circCRIM1表达低且早期)、中(circCRIM1表达高或晚期)、高(circCRIM1表达高且晚期)三组,发现这三组患者的死亡、复发和远端转移的风险显著不同(下图D-F)。此外,作者使用此预测circCRIM1表达对多西紫杉醇敏感程度的影响,发现在低风险组中,接受多西紫杉醇治疗的患者远端转移受控程度明显优于未接受多西紫杉醇治疗的患者(下图G)。这表明circCRIM1表达可用于预测NPC转移和多西紫杉醇耐药性。
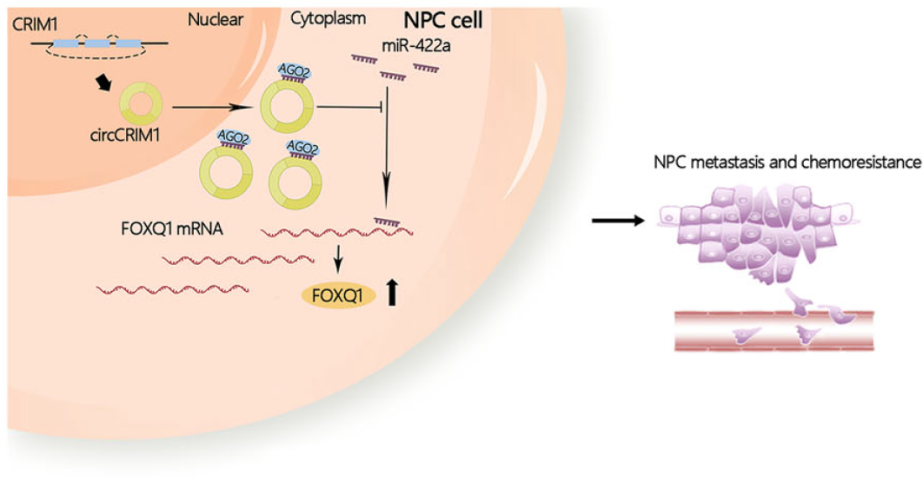
综上所述,研究表明,circCRIM1通过ceRNA机制调控miR-422a及其靶标基因FOXQ1,可作为标志物预测NPC的转移和多西紫杉醇耐药性(下图)。
结语
在这项研究中,作者首先鉴定到circCRIM1是NPC转移患者中显著上调的circRNA。其次,验证了circCRIM1通过与miR-422a竞争结合来调节FOXQ1的表达,从而影响NPC细胞的转移和多西紫杉醇耐药性。最后,作者构建并验证了基于circCRIM1表达和淋巴结分期的模型对NPC患者预后和多西紫杉醇耐药的预测能力。
circRNA的重要功能之一就是在ceRNA调控机制充当miRNA海绵。这篇文献提供了一种可以参考的研究“套路”。想做ceRNA机制的同学赶快码起来学习吧!



