之前小编介绍了采用了转录组测序技术做新冠病毒损伤宿主细胞机制探究的论文,今天再给大家带来一篇关于新冠病毒损伤机制和免疫反应研究的高分文章,发表在Advanced Science(IF:15.840)。值得一提的是,论文作者是咱们康测科技的重要客户哦~~
背景:新冠病毒SARS-CoV-2所造成的这场疫情给世界造成了巨大破坏,虽然临床上已发现病毒感染造成的细胞因子风暴是其致命的关键,然而仍欠缺器官层面上研究新冠病毒感染人体后反应的模型以及深度机制研究。现有的工作基本源于单一细胞株系或动物模型,存在较多不足,例如无法模拟气血屏障特性和肺组织的复杂微环境等。
内容:作者团队通过仿生技术共培养肺泡上皮细胞,微血管内皮细胞以及循环免疫细胞,建立了能反映气血屏障特性的模型,为研究机制和药物开发提供了便捷平台。
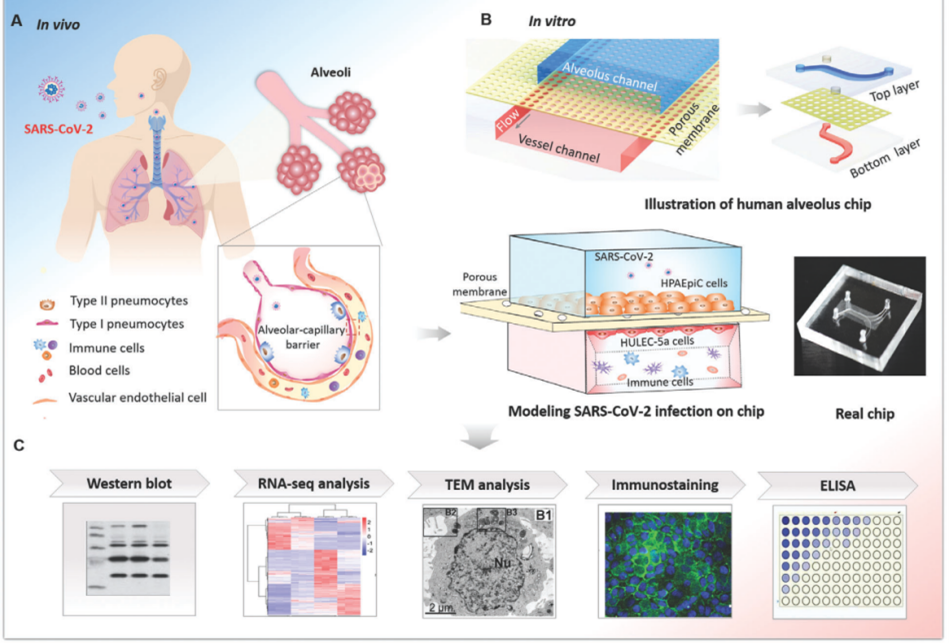
人肺泡细胞微流控芯片的建立
在这篇研究中,作者首先设计制作了如下图B所示的人肺泡细胞微流控芯片。该芯片分为上下两层,分别培养不同类型的细胞,中间由覆盖了胞外基质(ECM)的聚二甲硅氧烷膜(PDMS)隔开。其中,上层是人肺泡上皮细胞HPAEpiC,下层是肺微血管内皮细胞HULEC-5a。这些细胞以及其中的PDMS膜结构共同构造了能模拟气血屏障特性的微流控芯片,供后续实验使用。
新冠病毒侵染实验
构建了芯片后,作者首先用它观察了新冠病毒在侵染细胞时的特性。已知ACE2蛋白是新冠病毒侵入人体细胞的“受体”,而跨膜丝氨酸蛋白酶TMPRSS2则负责启动新冠病毒Spike蛋白与受体的结合。作者检测了ACE2和TMPRSS2蛋白表达量,结果显示两个细胞系中,两种蛋白都有表达(下图A)。而下图B中新冠病毒侵染的实验则表明,病毒的侵染对两种蛋白的表达量影响不大。
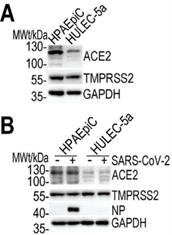
同时,侵染后的HPAEpiC细胞在下图C中展现出Spike蛋白的免疫荧光,显示了芯片上HPAEpiC细胞对于病毒的易感性。
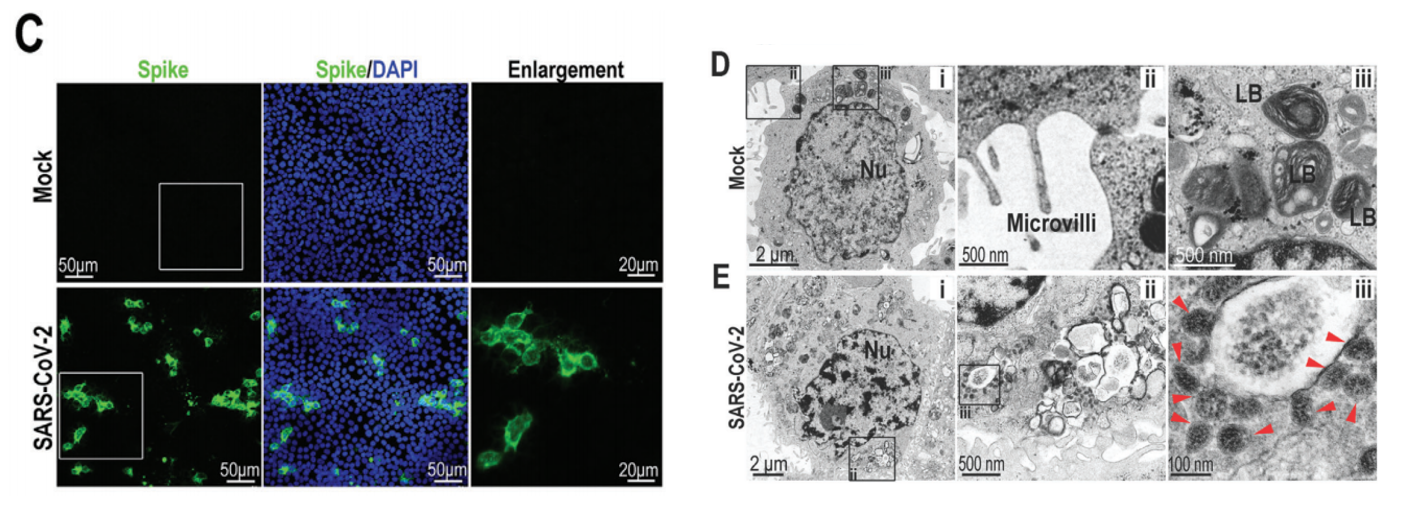
为模拟真实的肺泡感染情况,作者将新冠病毒从上层(肺泡上皮细胞HPAEpiC层)加入至微流控芯片体系中。培养三天后发现,未受病毒侵染的肺泡上皮HPAEpiC细胞和血管内皮HULEC-5a细胞在PDMS膜两边形成融合细胞层(下图A、B)。而通过分析新冠病毒Spike蛋白的荧光分布,可以发现受新冠病毒感染的细胞主要是肺泡上皮细胞中,而血管内皮细胞相对较少(下图C,D)。
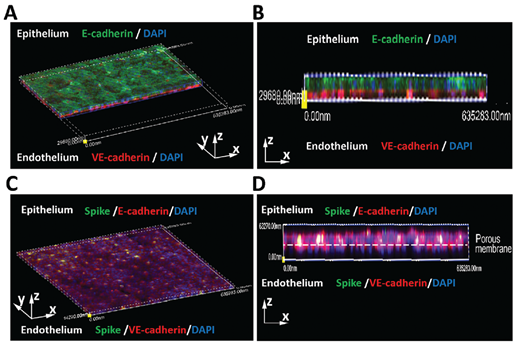
除此之外,通过检测黏着连接蛋白的免疫荧光和细胞贴壁汇合度(下图E、F),作者发现新冠病毒的侵染并未对上皮细胞或内皮细胞的融合产生影响。
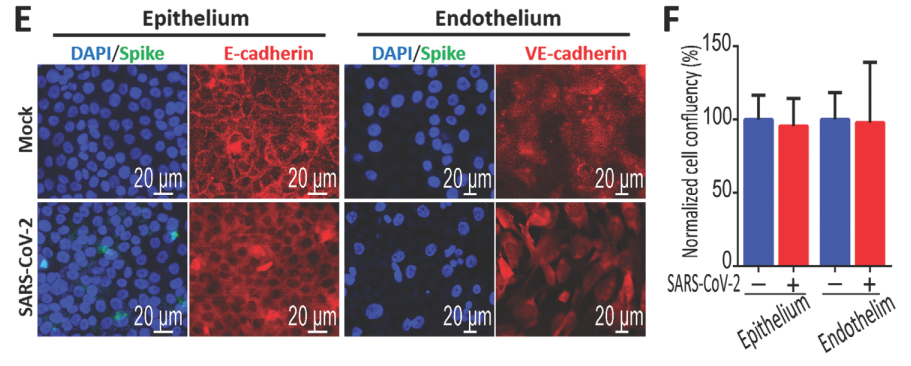
综合上述实验结果,证实新冠病毒入侵人体时,首要目标即是肺泡上皮细胞而非血管内皮细胞。
新冠病毒侵染细胞的转录组分析
初步研究了新冠病毒侵染肺泡的特性后,作者委托我们康测科技进行RNA-seq,以探究新冠病毒侵染宿主细胞后,其基因在转录水平发生了怎样的变化。
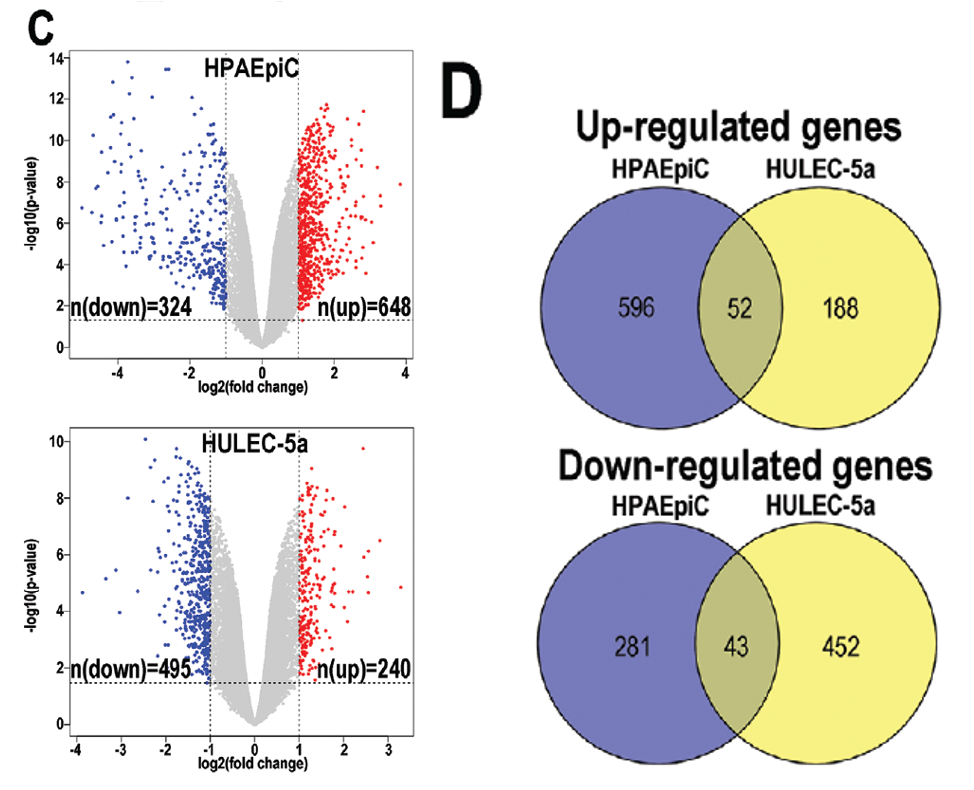
首先,在测序结果中,作者发现病毒在肺泡上皮细胞HPAEpiC中表达量更高(下图A、B),这与之前的实验结果相符,即人肺泡上皮细胞相比于血管内皮细胞更易受到新冠病毒的侵染。

从侵染前后宿主细胞差异表达基因的数目上来看,新冠病毒的侵染造成了宿主细胞基因非常明显的表达变化,差异基因数目非常多(下图C)。对上皮细胞和内皮细胞在感染前后的差异上下调基因分别取交集,得到了52个共有上调和43个共有下调基因(下图D)。这一结果表明两种细胞在受新冠病毒感染时转录水平上的响应存在着区别。
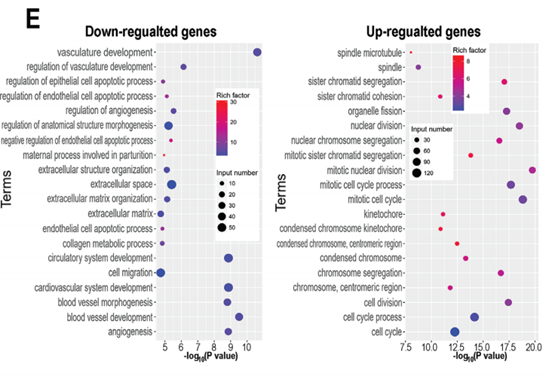
为诠释差异表达基因发挥的作用,作者对差异基因进行了GO/KEGG富集分析,结果表明,上皮细胞HPAEpiC中差异基因主要在细胞凋亡,细胞分裂以及有丝分裂周期相关terms富集(下图E)。
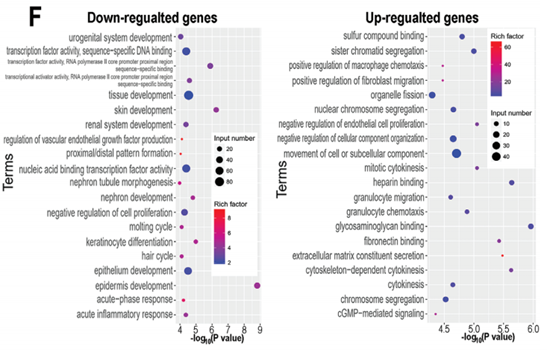
肺微血管内皮细胞HULEC-5a细胞的差异基因则主要在胞浆运动,转录因子活性以及趋化作用相关terms富集(下图F)。
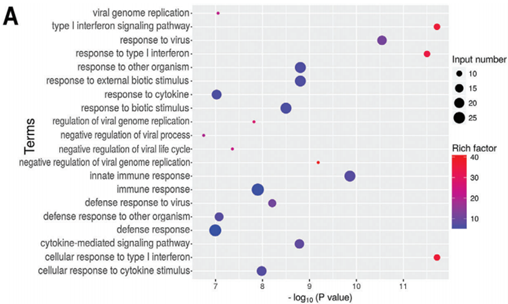
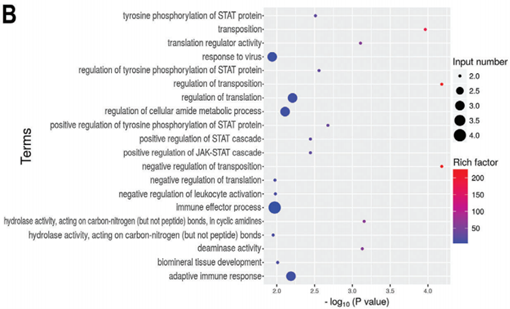
一般来说,病毒侵染会激起宿主细胞产生免疫反应。为了验证新冠病毒的侵染是否同样产生这一效果,作者检测了差异上调基因GO富集分析结果中与免疫相关的terms,发现肺泡上皮细胞与血管内皮细胞的免疫通路有区别:在上皮细胞HPAEpiC中主要是type1干扰素介导的信号通路以及细胞因子介导的信号通路差异显著(下图A);而在血管内皮细胞HULEC-5a中,差异基因则是主要富集到了JAK-STAT级联通路以及获得性免疫反应相关的terms(下图B)。
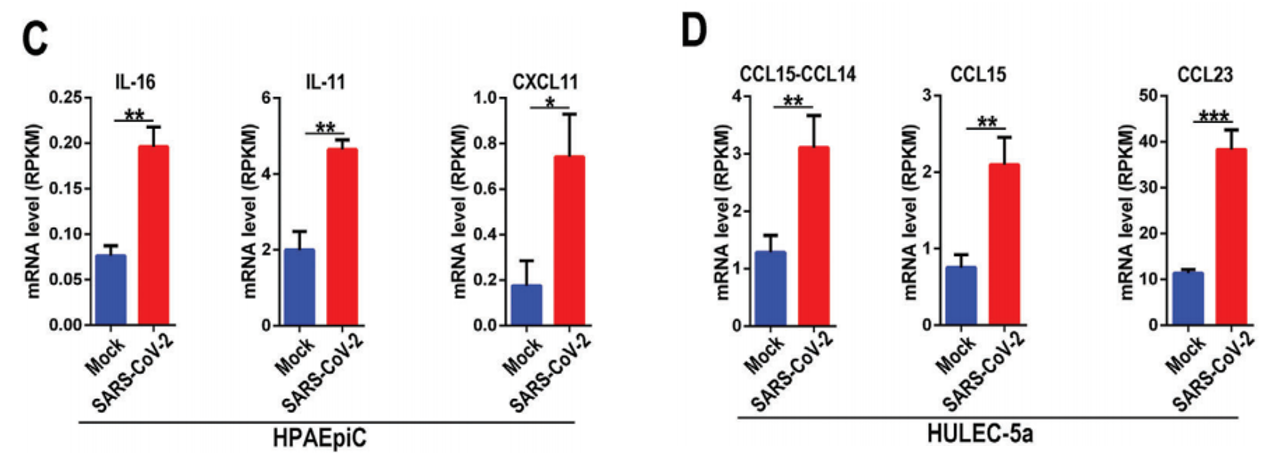
同时,作者也在两种细胞系感染前后的差异表达基因中,找到了与免疫相关的细胞因子,例如在上皮细胞HPAEpiC中鉴定到的是IL-16,IL-11和CXCL11,在细胞受感染后表达量显著上调(下图C)。而在血管内皮细胞HULEC-5a鉴定到显著上调的细胞因子则是CCL15-CCL14, CCL15与 CCL23(下图D)。
总体来看,转录组测序的数据揭示了受病毒侵染而发生表达量变化的基因主要与病毒易感性,免疫响应以及信号通路激活有关,而肺泡上皮细胞和血管内皮细胞在新冠病毒侵染后产生的转录响应存在着显著区别。这种区别也许可揭开新冠肺炎发病过程中宿主细胞复杂的相互作用机制。
肺泡细胞微流控芯片在受新冠病毒侵染中的免疫反应
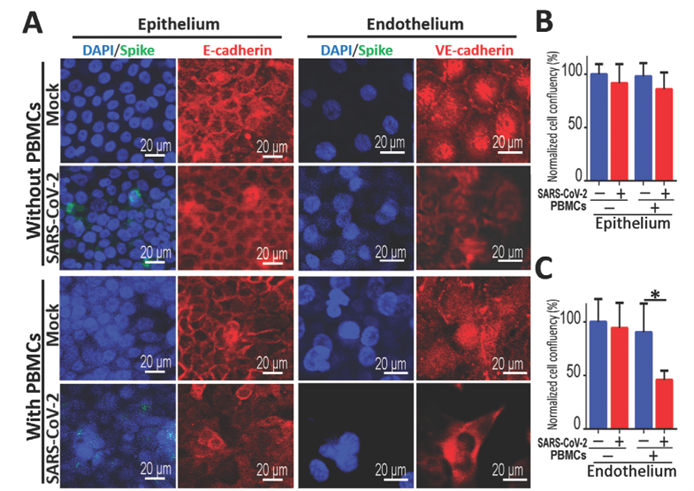
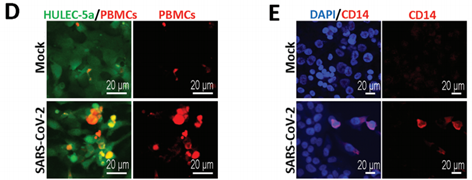
新冠病毒侵染人体后,肺中免疫细胞的聚集和广泛渗透可能对病情发展起到了促进作用。这里,作者以微流控芯片为平台,检测了循环免疫细胞在新冠病毒侵染过程中的作用。作者从健康人体内获得外周血单个核细胞PBMC(包含淋巴细胞)后加入了芯片的下层血管内皮细胞部分,以模拟PBMC随血液运输的效果,而新冠病毒依然从上层肺泡外皮细胞部分加入芯片进行侵染。结果发现,PBMC加入后,受病毒侵染的上皮细胞以及血管内皮细胞内的连接蛋白的分布被干扰,这与没有PBMC加入的结果截然不同(下图A),暗示气血屏障的损害与循环免疫细胞有直接的关联。此外,检测两种细胞的贴壁生长汇合度也得到类似的结论:在新冠病毒侵染的条件下,PBMC的加入显著降低了血管内皮细胞的贴壁生长汇合度(下图C)。有趣的是,上皮细胞贴壁生长汇合度没有受到显著影响(下图B)。
在微流控芯片中的实验结果表明循环免疫细胞会造成受新冠病毒侵染的血管内皮细胞的损伤,这一结果也暗示免疫细胞是造成人体在受感染后气血屏障受损的关键所在。
根据GO富集分析结果,受新冠病毒侵染的血管内皮细胞中,诸如巨噬细胞趋化作用在内的免疫细胞趋化作用相关基因表达上调。因而作者检测了芯片血管内皮细胞部分中循环免疫细胞在病毒感染前后的变化。结果显示,以单核细胞CD14+(一种巨噬细胞前体)为主的PBMC产生了募集和黏附现象(下图D、E),这与临床研究中报道的肺部炎症细胞渗透症状相似,说明这一人工肺泡模型可以反映出新冠肺炎患者的临床病理学特征。
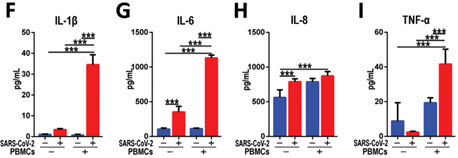
为进一步研究新冠病毒侵染所引发的炎症反应,作者在微流控芯片的血管内皮细胞一侧加入了促炎细胞因子。结果表明,即使在没有添加PBMC的情况下,趋化因子之一的白介素IL-6和IL-8含量在细胞受感染后显著增加,而在促炎细胞因子和PBMC共同作用下,受感染细胞中所有的细胞因子的含量均大量增加。
肺泡细胞微流控芯片作为药物研发平台的潜力
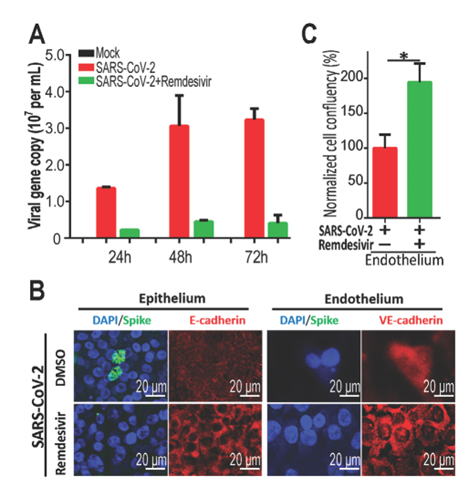
为了拓展微流控芯片的应用,作者选用了曾经一度被寄以厚望的药物——瑞德西韦来处理芯片并检验其效果。在瑞德西韦被从血管内皮层细胞加入后,作者检测了新冠病毒基因的拷贝数,结果发现其在瑞德西韦处理组中显著低于对照组(下图A),同时,瑞德西韦还能挽救PBMC对血管内皮细胞的损伤(下图B、C),这说明瑞德西韦具有抑制新冠病毒复制的能力,同时也展示了肺泡微流控芯片作为药物研发实验平台的潜力。
总结:
在这篇文章中,作者团队通过细胞共培养,构建了一个基于微流控芯片的人肺泡模型,用以作为研究新冠病毒侵染的平台,以便从器官层面探究病毒造成肺部损伤的机制和人体应对侵染的免疫反应。通过RNA-seq反映出的转录组数据表明,新冠病毒的侵染会诱导肺泡上皮细胞内的先天免疫反应,而在血管内皮细胞内则会增强细胞因子依赖的免疫反应通路,这为新冠肺炎的病理研究提供了新的视角。同时研究还发现,新冠病毒侵染模型中,循环免疫细胞的加入是导致炎症反应加剧、血管内皮功能障碍以及肺损伤的主要原因。除了研究病毒感染的机制外,这一平台还可作为药物研发实验平台。因其相较于普通的单一种类细胞实验更贴近人肺泡的真实环境,故可获得更有效的实验数据。
而在对模型进行实验的过程中,转录组测序的数据无疑为作者以及读者提供了研究方向的指引,康测科技独家的绝对定量UMI RNA-seq,为本文中的转录组数据的准确性提供了保障!同时,从送样到建库测序,再到数据分析,康测科技的一站式服务为研究者提供了最大程度的便利,节省大量时间和精力,快来试试吧~~



