
肝脏是肿瘤转移的高发部位,肝窦内皮细胞(LSEC)在肝脏的免疫耐受中起主要作用,具有作为癌症免疫治疗靶标的潜质。但是,目前还没有靶向LSEC的活体相关研究。本文作者研究了蜂毒肽纳米粒子(α-melittin-NP)对肿瘤转移到肝脏的影响:康测科技助力客户,通过转录组测序,证明α-melittin-NP通过激活LSEC,将肝脏免疫环境切换为激活状态,从而高效抵抗转移性病变。本研究为通过LSEC的免疫调节控制癌细胞肝转移开辟了一条新途径。
研究背景和待解决的科学问题:
背景:
- 肝脏是胃肠道癌症远端转移的常发脏器,手术切除是目前阻断癌细胞肝转移唯一可行的治疗方法,但复发概率高且生存率低,免疫疗法在预防肝转移方面也常常不尽人意。
- 调节肝脏中的耐受性抗原呈递细胞(APC)是激活特定抗肿瘤免疫反应并消除肿瘤转移的有效策略。前期研究表明肝脏主要组成成分LSEC具有作为APC的潜力。但是,由于LSEC缺乏特异性的吞噬受体,因此靶向调节LSEC非常具有挑战性。
- 阳离子防御肽是先天免疫系统中进化保守的分子,有广泛的免疫调节活性。蜂毒肽是天然的阳离子宿主防御肽之一,具有多种生物学作用,包括肿瘤细胞的细胞毒性和免疫调节作用。
待解决问题:α-melittin-NP是否能够特异性靶向LSEC来调节肝脏免疫耐受?如果可以,它又是如何有效抑制肿瘤的肝脏转移呢?
解析:
1. α-melittin-NP在体内对LSEC是否有特异性靶向作用?
首先作者对α-melittin-NP在小鼠体内的定位进行了研究,将锚定在荧光载体上的α-melittin-NP注射到Actb-EGFP小鼠,显微成像检测发现α-melittin-NP主要聚集在肝脏中(见下图) 。
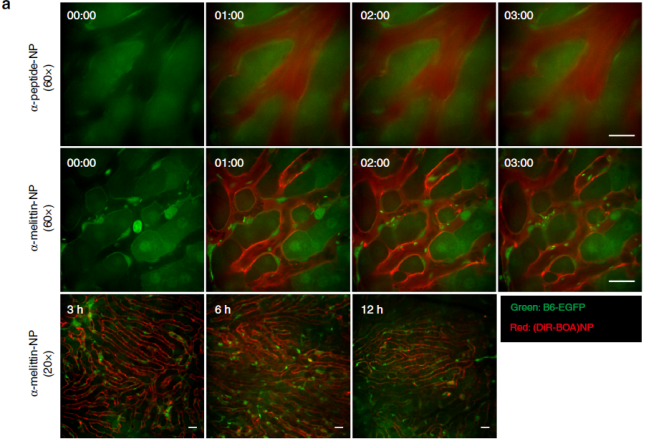
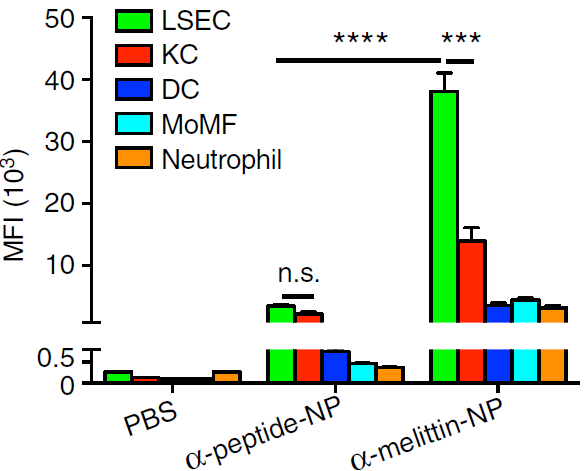
作者又进一步通过多色流式细胞仪分析了肝脏中非实质细胞对α-melittin-NP的摄取,发现LSEC吸收α-melittin-NP的效率比α-peptide-NP(阴性对照组)高出11倍(见下图),远高于其它细胞的摄取量,表明α-melittin-NP主要通过蜂毒肽序列在肝脏内靶向LSEC。
2. α-melittin-NP能引起LSEC活化并能显著逆转肝脏免疫系统微环境
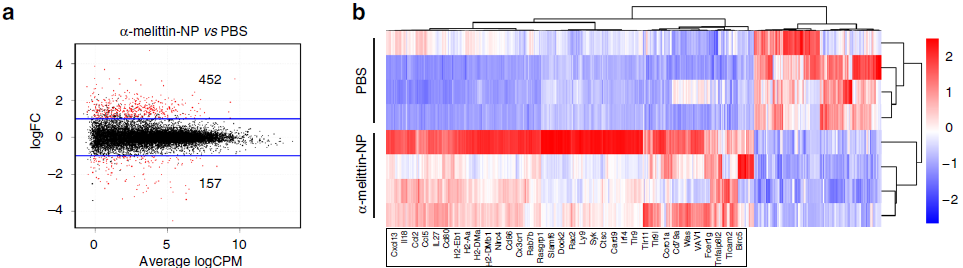
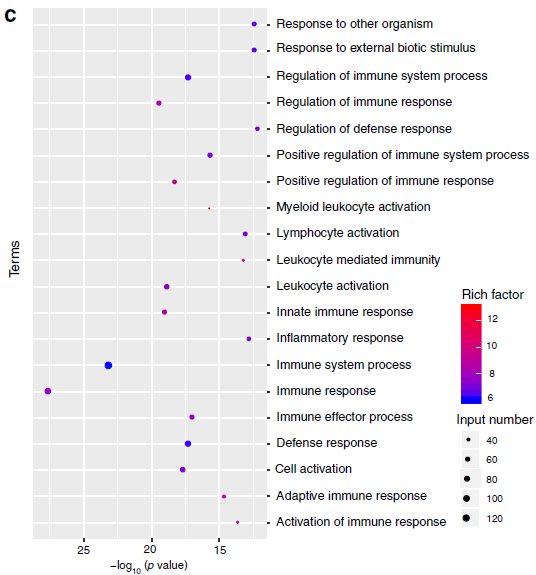
在确定了α-melittin-NP对LSEC的特异性靶向作用后,作者首先通过CD146(肝窦内皮细胞)免疫磁珠分选出LSEC,然后进行RNA-seq(下图a),发现上调表达差异基因主要参与免疫应答相关通路(下图b-c),表明α-melittin-NP具有强烈的免疫刺激特性,在转录水平上影响LSEC。
随后,作者用流式细胞仪在蛋白质水平上检测了LSEC共刺激分子的表达,并检测了浸润性白细胞的细胞类型和数量。结果表明α-melittin-NP能明显增加LSEC细胞中共刺激分子的平均荧光强度(MFI)值(下图d);先天免疫细胞(NK细胞、NKT细胞、巨噬细胞和中性粒细胞)和后天免疫细胞(B细胞、CD4+和CD8+ T细胞)在α-melittin-NP组明显增多(下图e)。这说明静脉内施用α-melittin-NP能有效活化LSEC并能逆转肝脏免疫微环境,使肝脏中的细胞因子/趋化因子环境发生巨大变化。
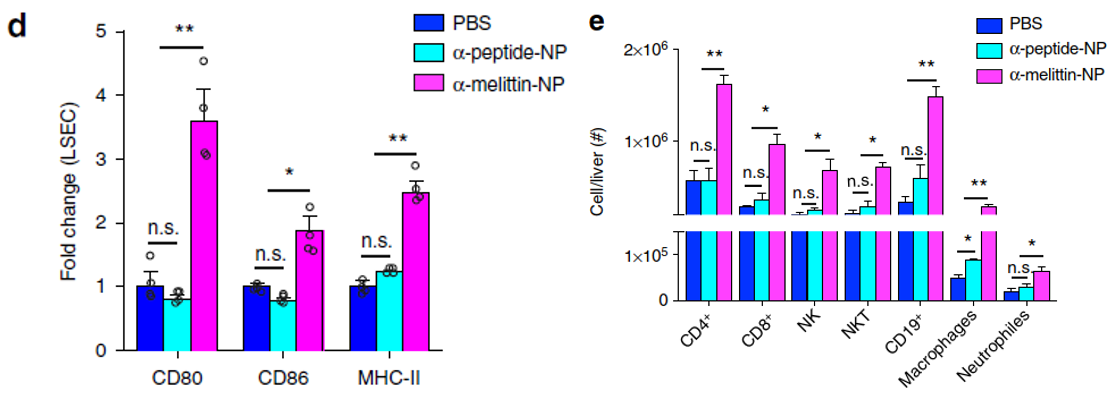
鉴于NK细胞在先天性免疫应答中起着至关重要的杀伤作用,作者随后确定了α-melittin-NP处理是否可刺激肝脏NK细胞的分化和成熟。结果显示α-melittin-NP组分化增殖期NK细胞(CD11b+CD27+)的比例明显提升,且其分化增殖标志物(CD69、Ki-67和Granzyme B+)的比例也显著提升(下图f-h)。
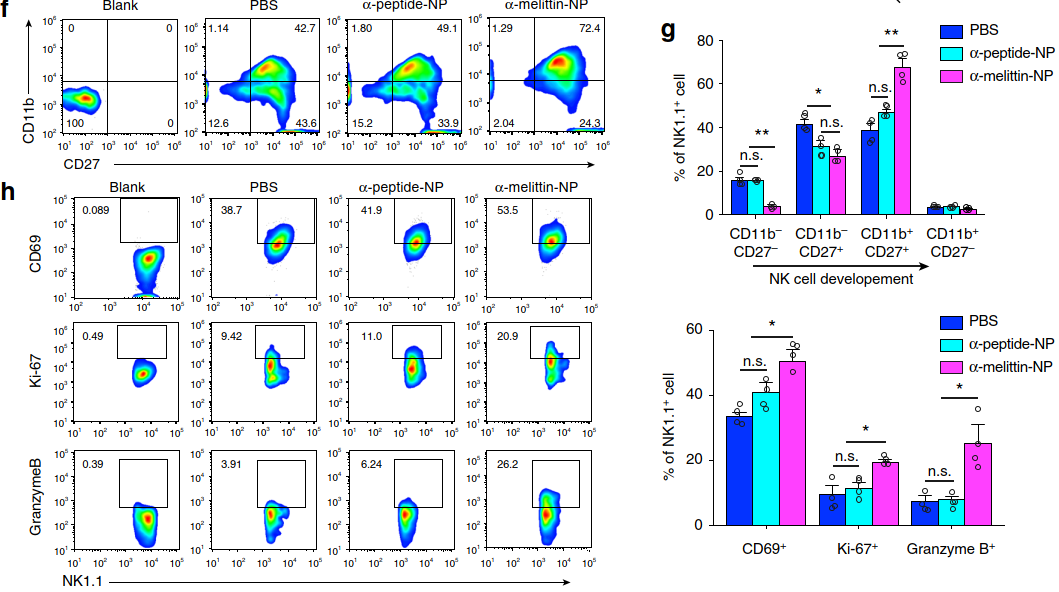
以上结果表明,α-melittin-NP通过靶标LSEC改变了肝脏的免疫状态,激活了肝脏的免疫微环境。那么,α-melittin-NP是否能通过调节肝脏微环境变化来阻止肿瘤细胞往肝脏转移呢?
3. α-melittin-NP可抑制实验性肝转移
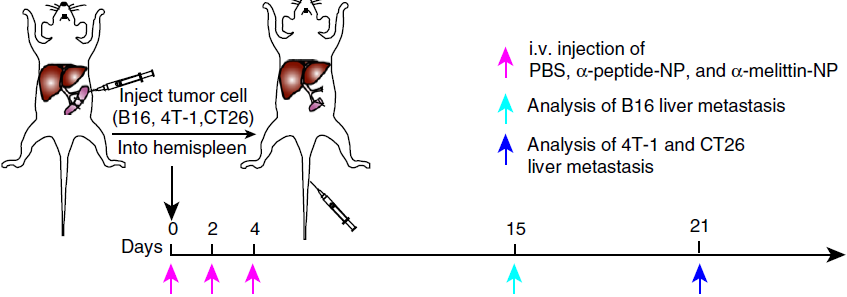
作者通过使用黑素瘤(B16F10)、三阴性乳腺癌(4T-1)和结肠癌(CT26)三种小鼠肿瘤模型来研究癌细胞转移(下图)。
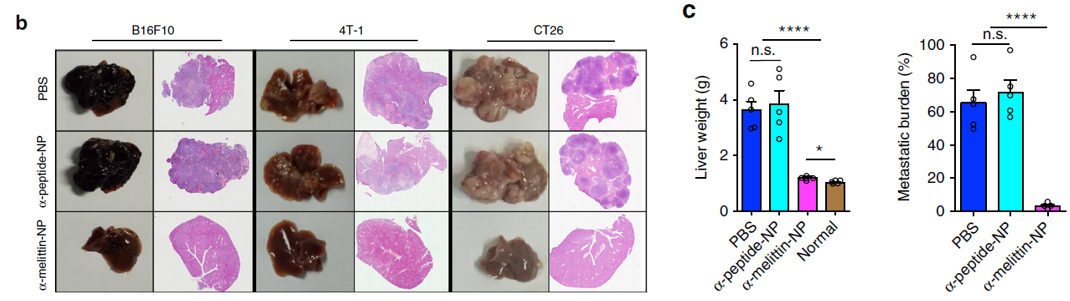
结果表明,未接受α-melittin-NP治疗的小鼠肝脏重量更重,肿瘤转移负荷更高(下图b-e)。
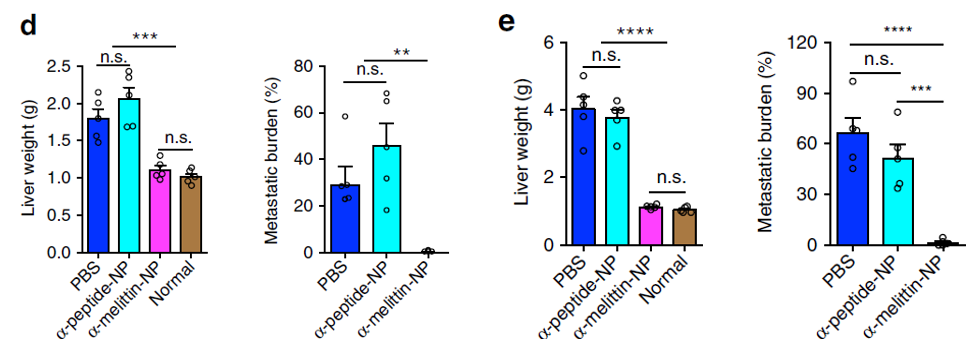
而经过α-melittin-NP治疗小鼠的存活率大大提高,并在接种肿瘤100天后依然存活(下图f–h),未接受α-melittin-NP治疗的小鼠均在约一个月之内死亡。
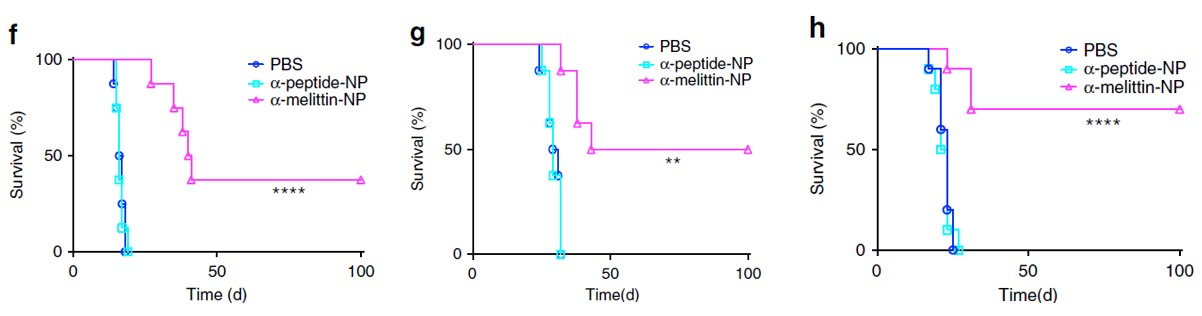
以上研究表明,α-melittin-NPs能够有效抑制实验性肝转移。那肿瘤小鼠肝脏中的微环境的变化又是怎样的呢?
4. α-melittin-NP能诱导T细胞免疫力的产生
作者通过免疫荧光和流式细胞术分析了黑色素肿瘤模型中肝脏浸润性白细胞的细胞类型和数量。结果表明,α-melittin-NP组的先天和后天免疫成分均显著增加(下图a)。免疫荧光染色也表明,经α-melittin-NP处理的小鼠中的转移性肝肿瘤被NK和CD8+ T细胞高度浸润(下图b)。
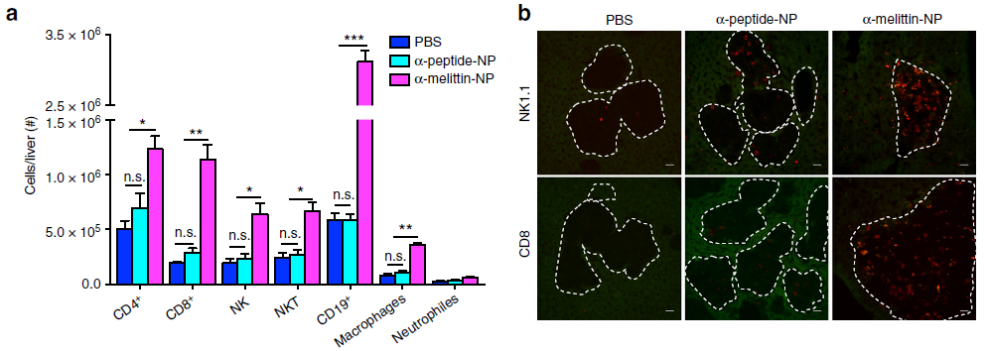
与正常小鼠的免疫调节效果一致,α-melittin-NP处理可导致肿瘤小鼠中分化和成熟NK细胞的百分比和数量显著增加(下图c-e)。这说明α-蜂毒素-NP能诱导肝脏中T细胞免疫力,激活肝脏的免疫微环境。
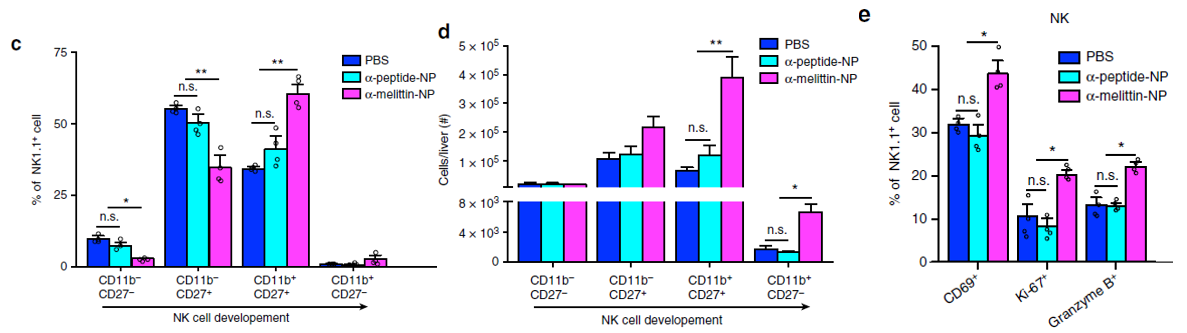
以上,作者证明在若干不同诱导肿瘤模型中,α-melittin-NP能抑制肿瘤细胞远端转移到肝脏。那么,在自发性肝转移模型中,α-melittin-NP还能发挥如此好的肝转移抑制效果吗?
5. α-melittin-NPs能抑制自发性肝转移
为了验证这一疑问,作者将表达mCherry(红色荧光蛋白)的4T-1乳腺癌细胞接种到BALB/c小鼠的乳腺脂肪垫中,并在达到450mm3时切除原发肿瘤,进行PBS、α-peptide-NP和α-mellittin-NP治疗(下图a)。
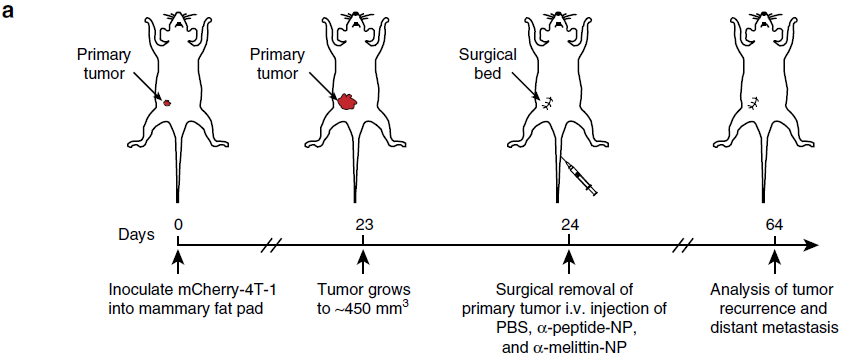
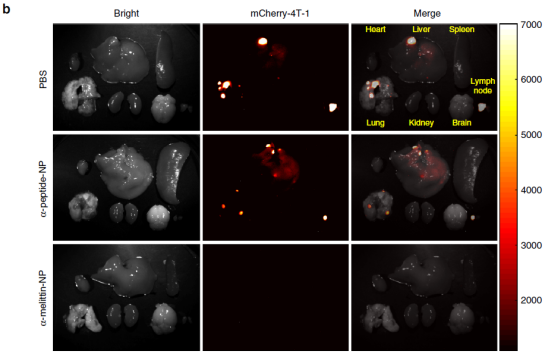
在原发肿瘤切除后第40天,对肝脏和其他器官进行荧光成像系统观察肿瘤转移情况,PBS或α-peptide-NP处理的小鼠的肝、肺和淋巴结中可以清楚地观察到mCherry-4T-1细胞的强荧光信号,表明在这些器官中产生了转移灶,而在α-melittin-NP处理的小鼠的脏器中未观察到mCherry-4T-1细胞的荧光信号(下图b)。
同时,接受PBS或α-peptide-NP处理的小鼠比接受α-melittin-NP治疗的小鼠具有更重的肝脏以及更多的肝和肺转移灶(下图c-d)。接受α-melittin-NP治疗小鼠的存活率也大大提高,80%在术后100天仍存活,而PBS和α-peptide-NP对照组中的小鼠均在手术后40天内死亡(下图e)。
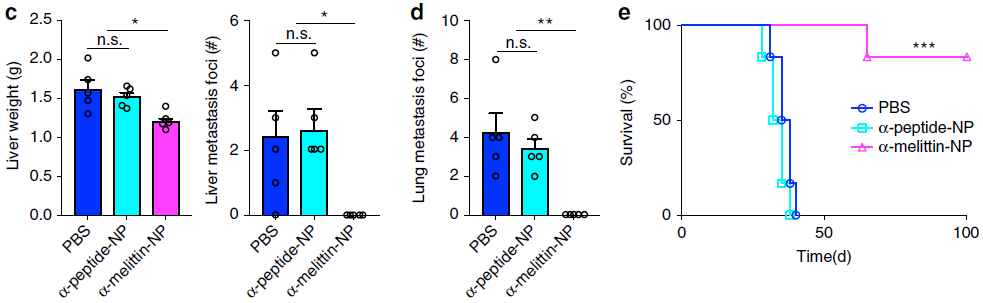
以上结果均表明,α-melittin-NP能有效抑制自发性肿瘤模型中的肝以及其他器官转移。
综上,α-melittin-NP能够通过特异性靶向激活LSEC来改善肝脏中的免疫耐受性,从而抵抗不同部位肿瘤的肝转移(模型见下图)。
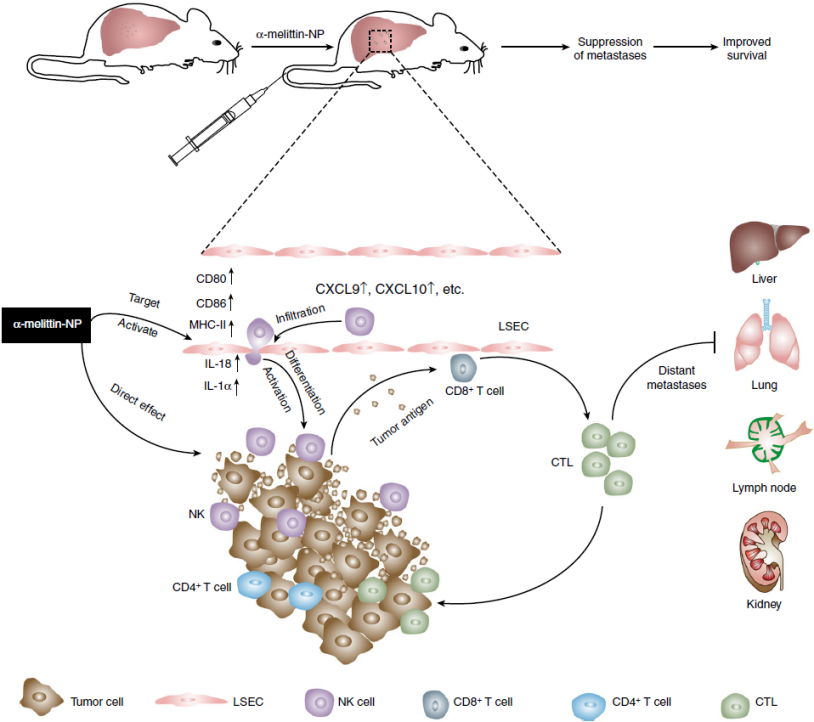
总结:
本研究表明,α-melittin-NP能有效抑制肿瘤肝转移:(1)α-melittin-NP能特异性靶向并激活LSEC,从而引发适应性抗肿瘤免疫应答;验证LSEC具有充当APC的潜力,LSEC激活是肿瘤抗原呈递和T细胞激活的先决条件。(2)α-melittin-NP诱导了免疫浸润变化以及NK细胞成熟和T细胞活化。(3)α-melittin-NP对转移性肿瘤具有直接的细胞毒性作用。因此,LSEC可能作为预防肝转移的初始免疫治疗靶点。本研究打破了LSEC耐受性的概念,为肝转移的治疗的临床应用提供了可能性。
通过这篇文献可以发现,简单的转录组测序就能发挥锦上添花的效果,让你的实验数据更加充实有力,说不定就成为了你冲高分杂志的有效工具哦!
参考文献:
Yu X , Chen L , Liu J , et al. Immune modulation of liver sinusoidal endothelial cells by melittin nanoparticles suppresses liver metastasis[J]. Nature communications, 2019, 10(1):574.



