核心转录调控回路机制如何研究?ChIP seq和ATAC seq联用描绘干细胞特异表观遗传图谱
本文中使用到的ATAC-seq、ChIP-seq、RNA-seq以及多组学联合分析,康测科技均可完成!
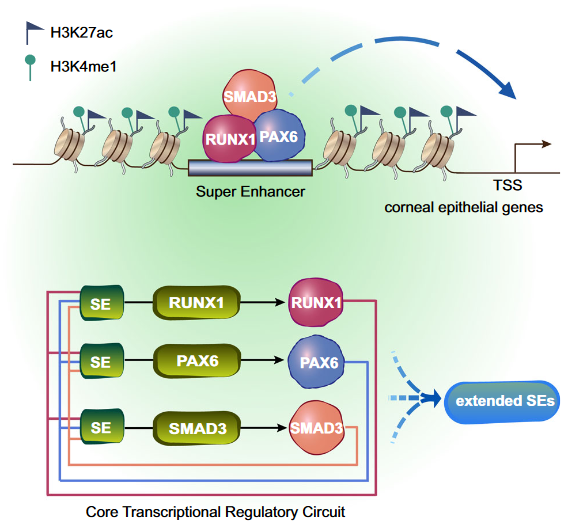
干细胞的身份、可塑性和稳态主要依靠谱系限制的染色质表观和转录调控网络的精准编排。下面这篇近期发表在NC上的文章,作者利用高通量测序研究利器ChIP-seq联用ATAC-seq 首次描绘了人类角膜缘干细胞(limbal stem cell,LSC)的组蛋白修饰和染色质可及性图谱,构建了基于超级增强子与转录因子互作的转录调控网络。鉴定出RUNX1、PAX6和SMAD3(RPS蛋白复合体),相互调控组成核心转录调控回路(core transcription regulatory circuitry,CRC),共同主导角膜上皮细胞(corneal epithelial cell,CEC)谱系特异性的顺式作用图谱。

研究背景和待解决的科学问题
位于角膜和球结膜交界处的角膜缘区域的角膜缘干细胞,通过不断进行自我更新和分化,向中央角膜迁移来替代死亡或受损的角膜上皮细胞,负责维持角膜上皮的更新及损伤修复。LSC缺乏或病变会导致角膜混浊、新生血管侵入、上皮结膜化、角膜基质排列紊乱等症状,是临床上造成致盲的主要原因之一。因而,探究LSC命运决定和稳态维持的机理具有重要意义。
超级增强子是由一系列增强子元件缝合在一起的调控元件,主要调控维持细胞身份相关基因的表达。一般超级增强子区域具有高水平H3K27ac修饰。
近期研究表明,某些转录因子通过结合自身的超级增强子实现自我调节,而且这些转录因子自身会结合彼此的超级增强子,从而形成核心转录调控回路。LSC中的转录因子调控网络未见报道,值得进一步发掘和研究!
因此,本文想要解决的科学问题,就是希望通过描绘LSC的表观遗传图谱,鉴定关键转录因子,进一步解析LSC核心转录调控回路的调控机制。
研究思路解析
1. ChIP-seq及ATAC-seq联合分析绘制LSC细胞表观调控图谱
组蛋白修饰和染色质可及性是重要的表观调控方式,组蛋白修饰位点往往与转录调控的顺式作用元件紧密相关,而染色质的可及性也是转录激活的重要表征;作者通过ChIP-seq及ATAC-seq描绘LSC的表观调控图谱,为揭示LSC表观调控机制提供研究基础。
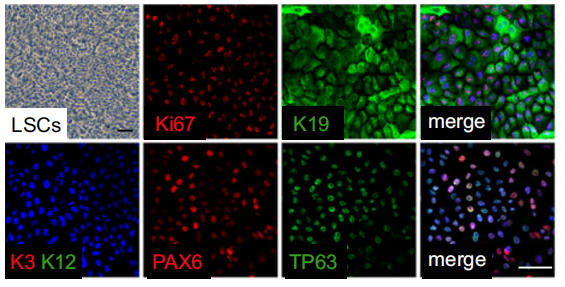
(1)作者利用无饲养层培养体系获得纯合的LSC原初胚胎干细胞,下图显示了LSCs中干细胞标志基因(PAX6,TP63和KRT19)及细胞增殖标志基因(Ki67)高水平表达,而CEC标志基因KRT3和KRT12几乎不表达。这些关键标志物免疫荧光染色验证了实验材料的干细胞特性。
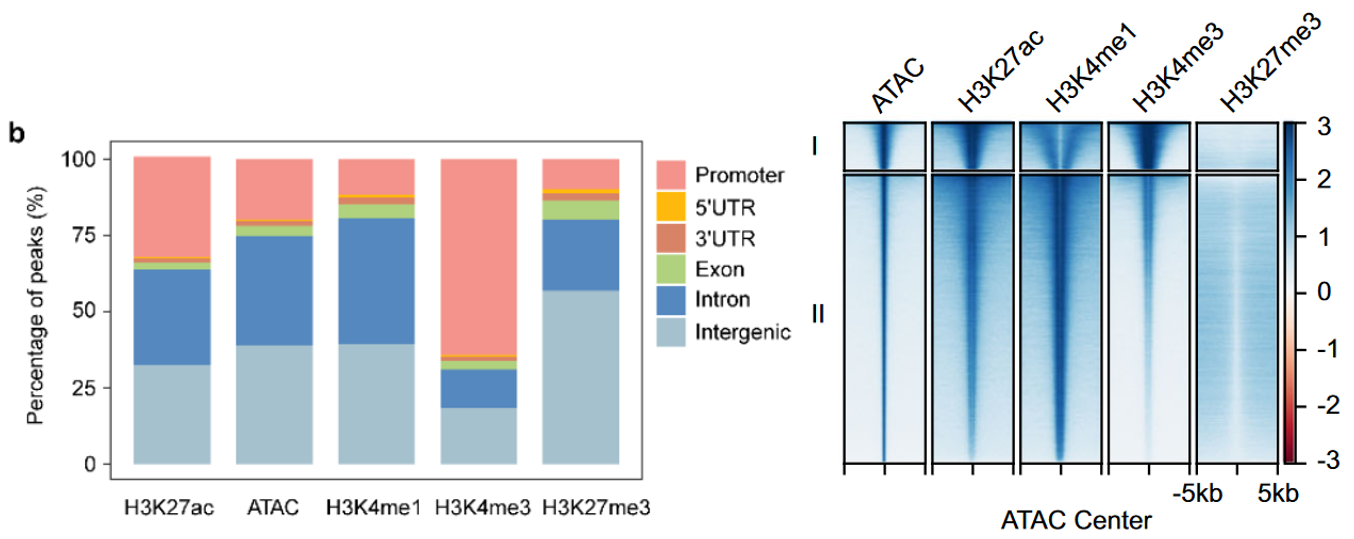
(2)作者分别用ChIP-seq和ATAC-seq来检测LSC细胞中四种组蛋白修饰(H3K27ac, H3K4me1, H3K4me3, H3K27me3)及染色质的可及性,绘制LSC细胞表观调控图谱,进一步分析表观修饰和染色质可及性的关联性。
- ATAC-seq鉴定的染色质开放区域主要分布在基因间区和内含子区,以及少部分的promoter区域;H3K27ac和H3K4me1修饰区域与ATAC的分布模式相似;而H3K4me3修饰主要分布在启动子区(下图左);
- 作者进一步将ATAC-seq鉴定的染色质开放区域进行分类(下图右):
a. 激活的启动子区域:高水平H3K27ac和H3K4me3修饰,低水平H3K4me1修饰;
b. 激活的增强子区域:高水平H3K27ac和H3K4me1修饰,低水平H3K4me3修饰;
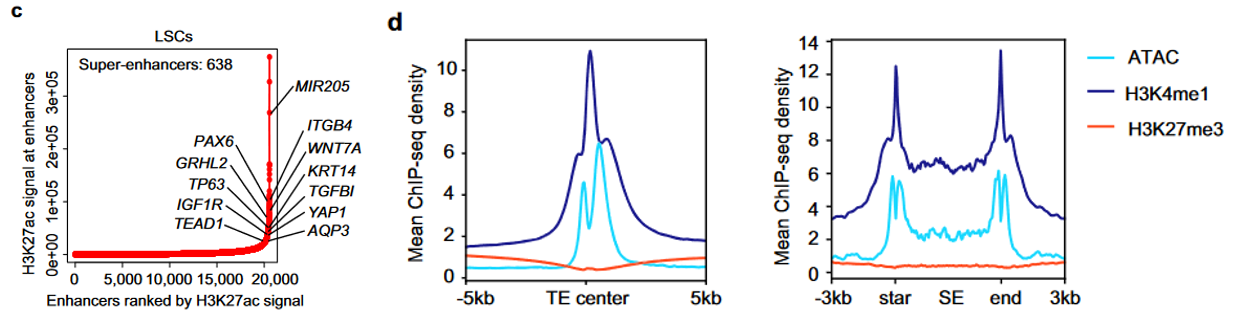
(3)作者根据H3K27ac修饰程度鉴定了LSC细胞特有的超级增强子(SE)和传统增强子(TE)(下图c),其中包含已报道维持LSC干细胞特性的超级增强子关联基因TP63和PAX6;而ATAC和H3K4me1的高peak信号及H3K27me3的低peak信号在TE和SE区域的分布也验证了这些区域的高转录活性(下图d);
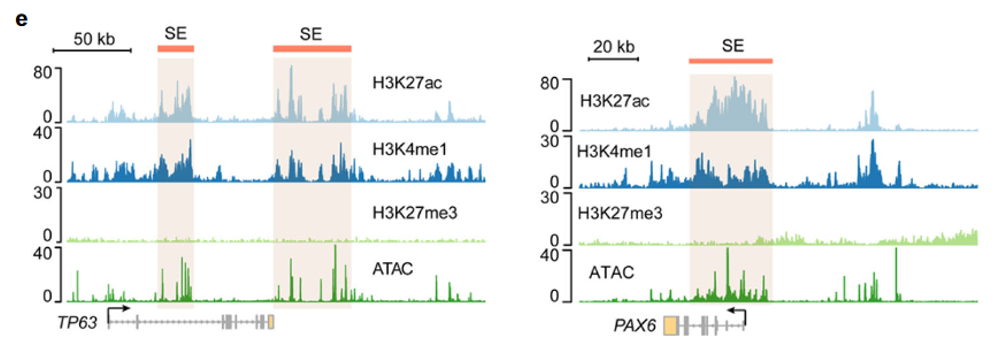
(4)作者进一步展示了上皮分层调节因子TP63和PAX6的染色质可及性及组蛋白修饰水平之间的相关性(下图e),与上图d的结果一致:
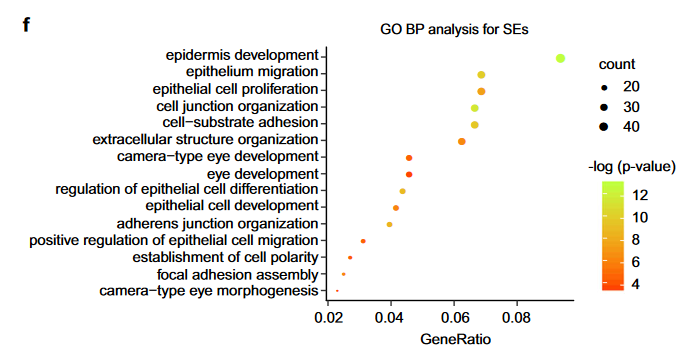
(5)对鉴定到的SE关联基因进行GO注释,发现调控LSC细胞生物学过程(如增殖,迁移,细胞极性和细胞连接组织)相关的基因显著富集(下图f);
上述实验作者通过对特定的LSC细胞进行ChIP-seq和ATAC-seq,鉴定染色质核心调控元件,结合染色质可及性的检测,绘制表观调控图谱,鉴定到调控LSC干细胞命运决定的功能相关的超级增强子及其关联基因。
2. LSC细胞核心转录调控回路模型分析
前人研究已表明,核心转录调控回路在决定组织特异性和疾病发生过程中发挥了重要作用,因此作者进一步分析LSC细胞中关键转录因子及超级增强子之间的相互调控作用。
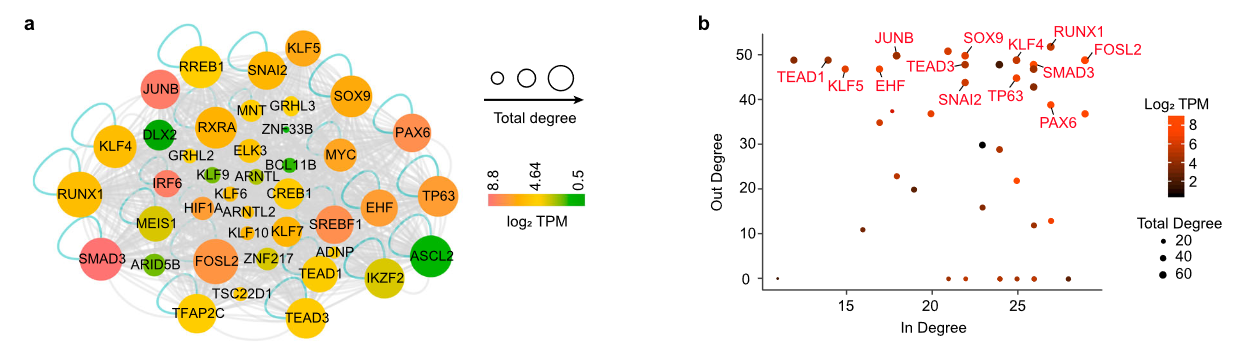
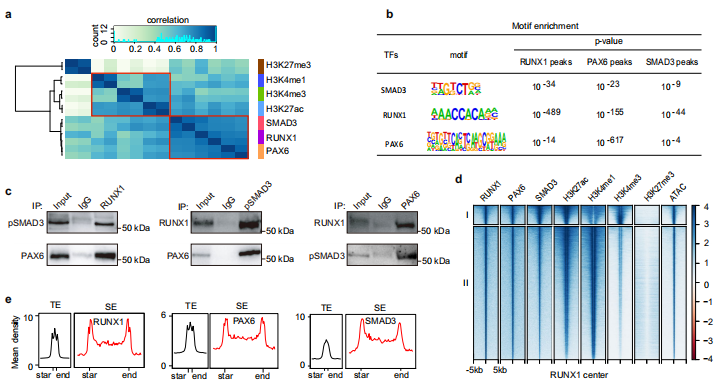
(1)超级增强子和开放染色质区域通常高度富集细胞类型特异性转录因子。因此,作者通过整合H3K27ac和ATAC数据,分析维持干细胞特异性转录因子及超级增强子之间的相互作用网络(下图a)。
(2)作者进一步分析了结合超级增强子的转录因子在网络中连通性,筛选出多个参与回路调控的转录调控元件及转录因子(下图b);大多数转录因子也是其他鳞状上皮组织的核心调控因子,暗示这种相互作用网络在上皮稳态中的一致功能。
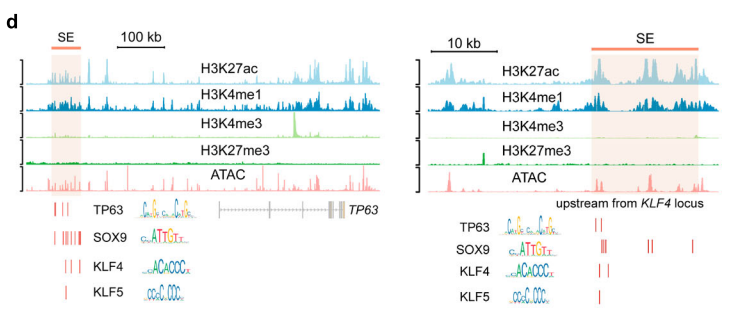
(3)分层相关TF的基序,如TP63、KLF7、SOX9、KLF4和KLF5,均在它们自身基因座附近的SE处富集(下图d)。这些SE调节的TF形成了一个相互关联的调节模型,可以平衡分层上皮的增殖和分化。
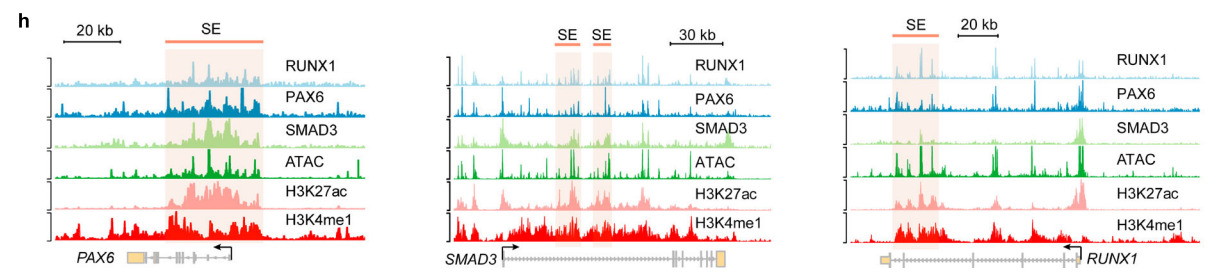
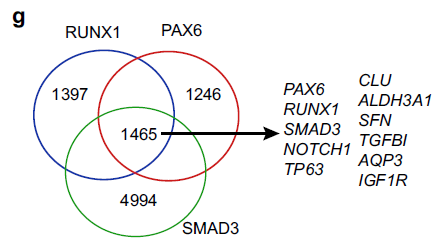
(4)此前有研究表明PAX6在LSC命运决定中扮演关键转录因子的作用,因此作者希望进一步鉴定PAX6相关的CRC调控网络成员。作者剖析了RPS(RUNX1,PAX6, SMAD3)的结合谱,发现PAX6基因座内具有高水平H3K27ac、H3K4me1和ATAC信号的大型SE结构域被RPS共同占据。同样,RUNX1和SMAD3基因座内的SE元件也表现出了RPS的共定位(下图h)。因此,ATAC-seq及ChIP-seq结果显示了三个蛋白有相互作用。
(5)除此之外,RPS 还能调节其他关键TF,形成一个调节网络(下图i):

上述结果表明,超级增强子调控的RPS可以反过来相互共调控各自的超级增强子,也共同调控了其余TF的超级增强子,形成了一个LSC特异的CRC调控回路。
3. RUNX1和SMAD3在LSC细胞命运决定中的调控机制
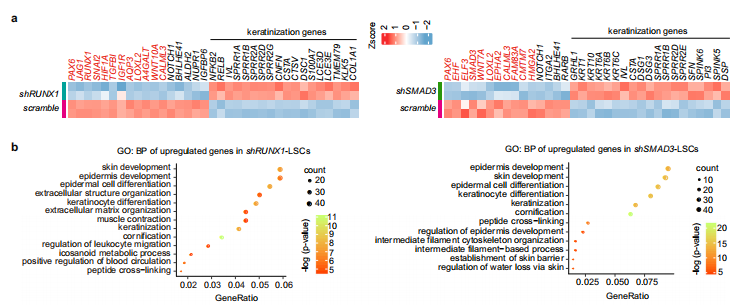
(1)为了进一步验证RPS对LSC性质的调控作用,作者敲低了RUNX1和SMAD3:
- RUNX1或SMAD3敲低导致LSC性质决定基因(包括PAX6)表达显著下调,角质化上皮特异基因的表达显著上调(下图a);
- GO富集分析表明任一组中上调的基因均与角化以及表皮的发育、分化和功能相关(下图b)。
(2)GSEA分析表明RUNX1或SMAD3敲低后,LSC表达模式向SESC(皮肤上皮干细胞)表达模式转变(下图c)。
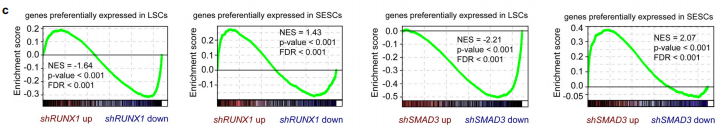
上述结果表明,RUNX1、SMAD3与PAX6蛋白,在维持LSC干细胞身份的调控中起到关键作用。
4. RPS协同作用调控下游LSC身份基因的表达:
RPS三个成员在LSC干细胞身份调控中起到关键作用,那么三者是如何组成CRC回路进行调控呢?
(1) 作者做了一系列实验来验证CRC转录调控回路之间的相互作用及相关性:
- RUNX1/PAX6/SMAD蛋白在基因组上的结合模式相似,并伴随转录激活型组蛋白修饰;(下图a);
- RUNX1/PAX6/SMAD各自的motif均在另外两个蛋白的peak中有富集(下图b);
- COIP实验证明了RPS蛋白间的相互作用(下图c);
- RPS蛋白在基因组中的结合位点高度重叠,在SE和TE上的分布模式高度相似(下图d,e)。
这些实验证明了RPS可能以复合体的形式识别相互的SE,调控自身及靶标基因的表达。
(2) RPS下游共同靶标基因与维持LSC干细胞身份密切相关:
- 转录因子hotspots是由多个核心转录因子共同占据的功能调控元件,能确定了细胞种类。作者发现RPS共结合热点与许多关键的角膜上皮基因有关,如CLU、ALDH3A1、NOTCH1、TP63和SFN39以及RPS本身(下图g);
- 举例来说,RPS复合物在TGFBI、AQP3和IGF1R的基因座上占据了SE和TE(下图h);
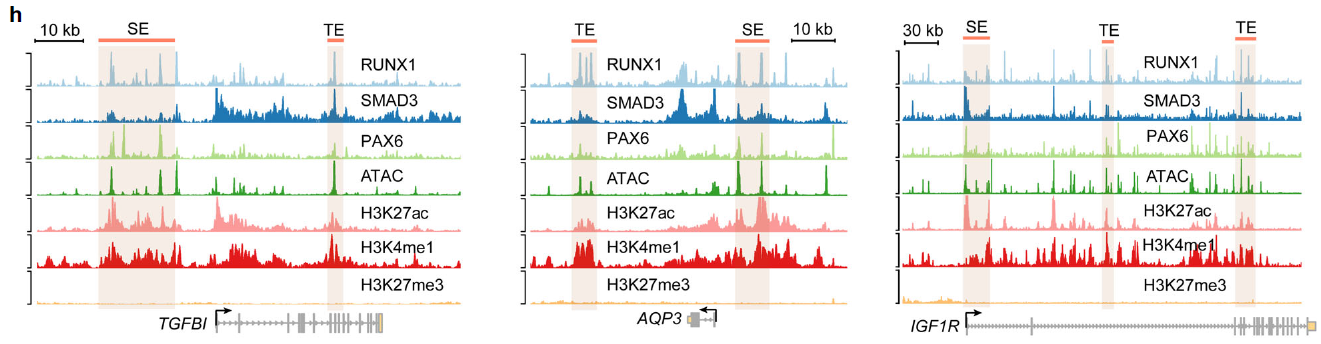
(3) GO和KEGG分析发现RPS hotspots相关基因富集了上皮相关生物过程和信号通路(下图i)。
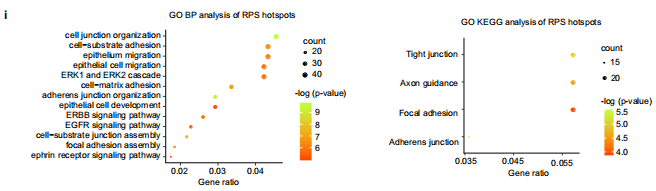
上述结果表明,RPS协调作用,通过CRC调控回路维持LSC干细胞身份及稳态。
5. RUNX1在维持LSC身份中的转录调控机制:
干细胞身份及稳态维持与表观修饰息息相关,因此作者进一步探索了CRC核心成员RUNX1对组蛋白修饰的调控作用:
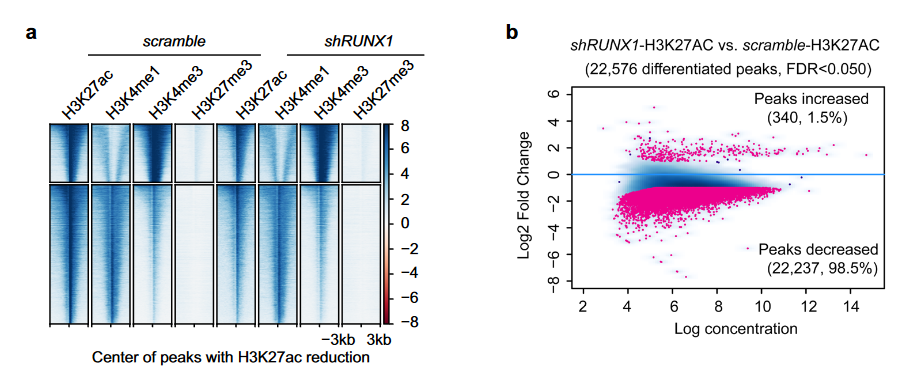
(1) 敲低RUNX1不影响H3K4me1、H3K4me3、和H3K27me3的修饰水平(下图a);
(2) 但是,敲低RUNX1导致全基因组范围H3K27ac修饰水平降低(下图a、b);
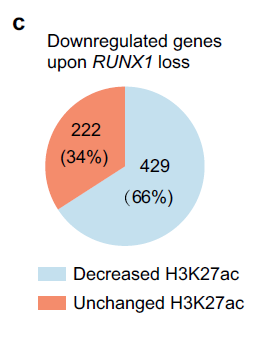
(3) 联合RNA-seq 分析表明,大部分转录下调表达的基因会伴随着靠近其基因座的H3K27ac信号的减少(下图c);
(4) 敲低RUNX1同时也会导致全基因组水平上SE和TE上的H3K27ac修饰水平降低(下图d);
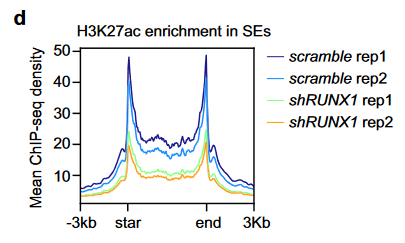
(5) 敲低RUNX1后,在PAX6和TGFBI基因座中,与RUNX1结合超级增强子结构域中H3K27ac水平显著降低(下图f)。
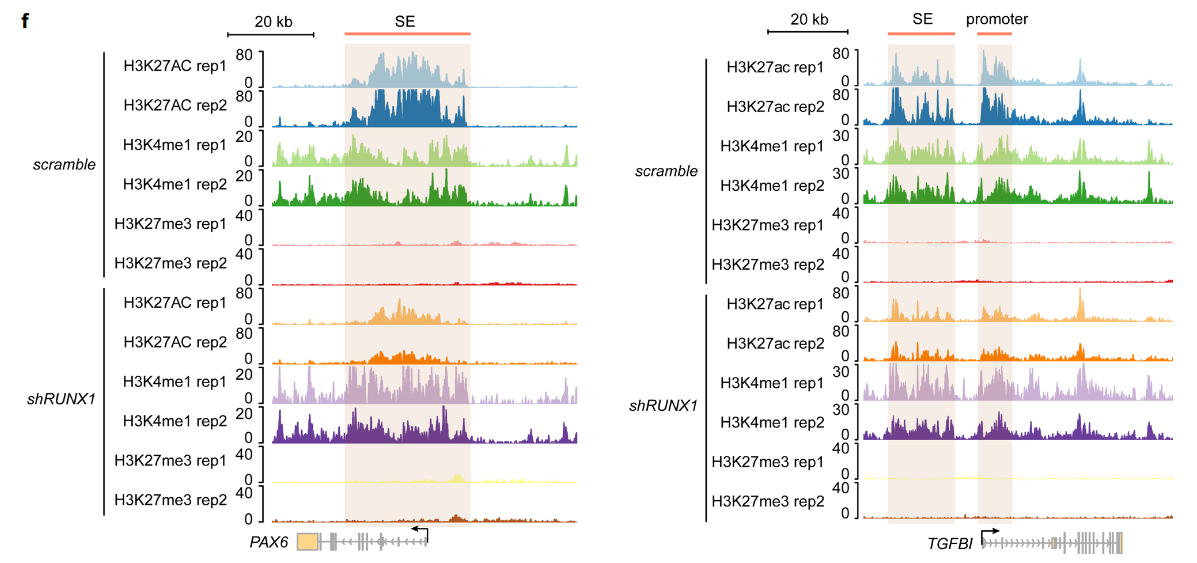
这些数据表明,RUNX1主要通过调控SE区域中H3K27ac修饰水平来影响靶基因的转录水平。
总结
作者通过ChIP-seq和ATAC-seq解析LSC的4种组蛋白修饰 (H3K27ac、H3K4me1、 H3K4me3和H3K27me3)和染色质可及性图谱,构建了基于超级增强子与转录因子互作的转录调控网络。鉴定出RUNX1和SMAD3是维持LSC干细胞身份和稳态必不可少的转录因子。发现RUNX1、PAX6和SMAD3(RPS)蛋白相互作用,并形成一个LSC特异的CRC调控回路。还发现了RUNX1下游调控机制,主要通过调控LSC中超级增强子和典型增强子区域的H3K27ac修饰水平,从而影响靶标基因的转录。
Reference:



