
研究背景
此前已知发生在DNA上的6mA甲基化修饰在微生物基因组上普遍存在,且可调控微生物众多的重要生物过程。然而,6mA修饰是否可以发生在高等真核生物中,并同样发挥重要的调控功能呢?
这篇Cell所关注的就是果蝇基因组上是否存在6mA修饰;如果存在,这种修饰是否可以调控果蝇关键的生物学过程呢?
一、果蝇基因组上的6mA修饰
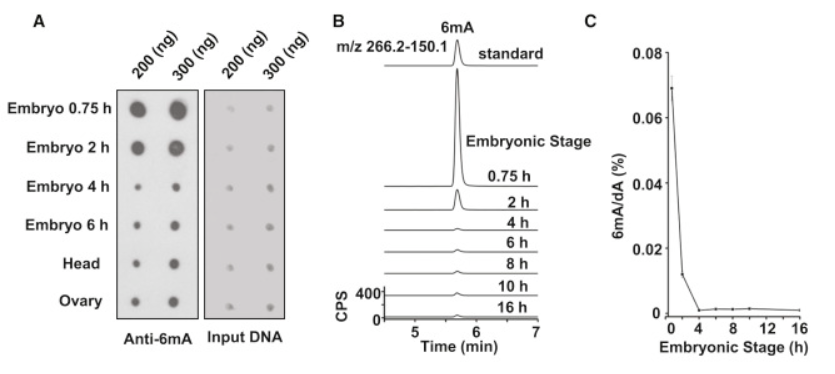
为了了解果蝇基因组上是否发生了6mA修饰,作者先利用可特异识别6mA修饰的抗体进行了dot blot(下图A),发现只有果蝇胚胎早期中的6mA信号很强,成体组织、胚胎晚期中该修饰均较微弱,表明在其胚胎发育过程中,6mA修饰可能是一个动态过程。
接着,作者通过超高效液相色谱-三重四极杆质谱联用(UHPLC-MRM-MS/MS)对果蝇基因组上的6mA修饰进行了定量(下图B, C),这一修饰在胚胎发育的0.75h时达到峰值(~0.07%),在随后的4-16h降低到极低水平(~0.001%),证实果蝇基因组上存在6mA修饰,且这种修饰的确是动态变化的。
二、果蝇胚胎中6mA去甲基化酶活力强
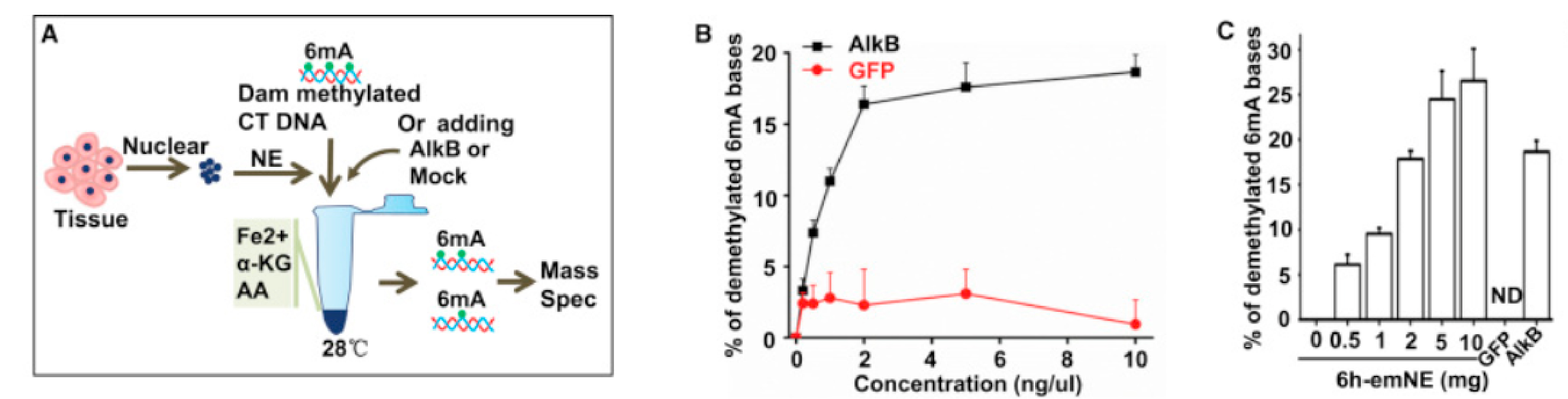
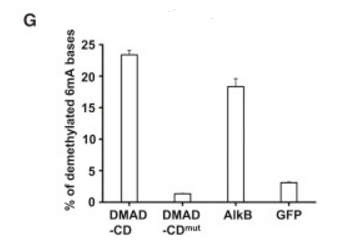
着果蝇胚胎发育的进程,其中的6mA修饰随之大幅下降,作者由此猜测,可能是6mA去甲基化酶活力的增强介导了上述过程的发生。因此,作者进行了体外的6mA去甲基化实验(下图A),分别采用AlkB(细菌中已知的6mA去甲基化酶,阳性对照酶)和mock处理具有6mA修饰的DNA,通过质谱检测去甲基化比例。结果显示(下图B),甲基化底物经AlkB处理后,以剂量依赖的方式被去甲基化,而GFP处理组无明显变化。在DNA中加入果蝇的核提取物,甲基化底物同样以剂量依赖的方式被去甲基化(下图C)。
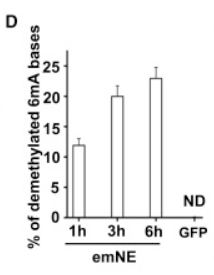
将果蝇不同发育期的核提取物分别和甲基化底物进行孵育,提取物的去甲基化能力随着果蝇的发育逐渐升高(下图D),表明果蝇胚胎发育过程中6mA修饰丰度与6mA去甲基化酶活性负相关。
三、DMAD与6mA去甲基化有关
既然果蝇胚胎发育过程中的6mA丰度与其去甲基化酶酶活呈负相关,究竟是哪个蛋白导致了6mA的去甲基化呢?
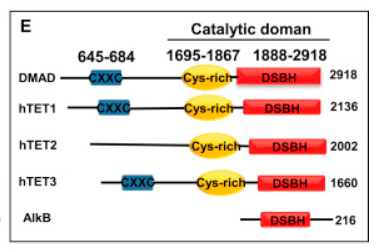
前期研究已发现,哺乳动物的蛋白Tet在5mC的去甲基化中发挥重要作用,作者在果蝇中找到一个和Tet类似的蛋白DMAD,它们都有CXXC锌指结构域、Cys-rich结构域和DSBH结构域(下图E)。
DMAD的表达量随着果蝇胚胎发育的过程逐渐升高(下图F, G),故DMAD的表达量同6mA丰度负相关。
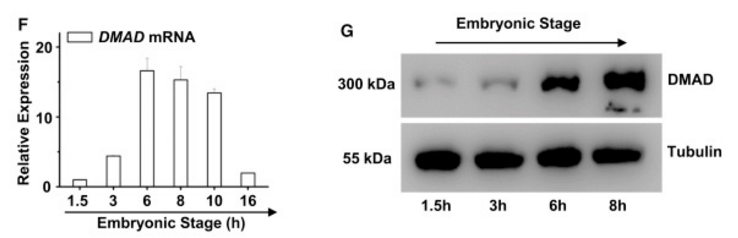
作者由此推测DMAD有可能具有6mA去甲基化能力,为了验证这一猜想,作者接着进行了Immunodepletion免疫耗尽实验,用DMAD抗体处理后,核提取物的去甲基化能力显著下降(下图H);不仅如此,用dsRNA敲除了DMAD后,核提取物的去甲基化能力也显著下降(下图J)。这些都表明DMAD是6mA去甲基化酶。

四、DMAD是果蝇发育所必需的
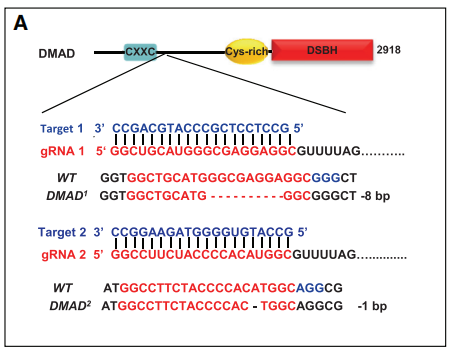
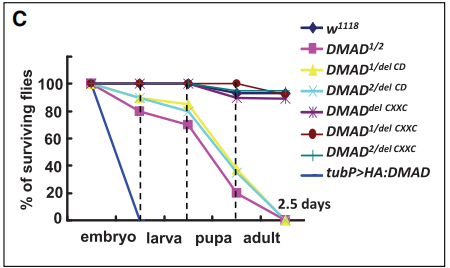
然而,敲除DMAD会造成果蝇在胚胎发育晚期死亡,暗示该蛋白可能在果蝇胚胎发育过程中发挥重要作用。作者接下来对DMAD的发挥的生理功能进行了探究。利用CRISPR/Cas系统突变DMAD(下图A),分别得到DMAD1和DMAD2,DMAD1/2果蝇大多在蛹期死亡(下图C)。
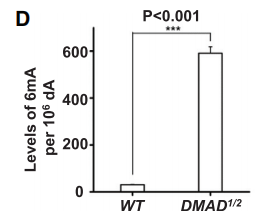
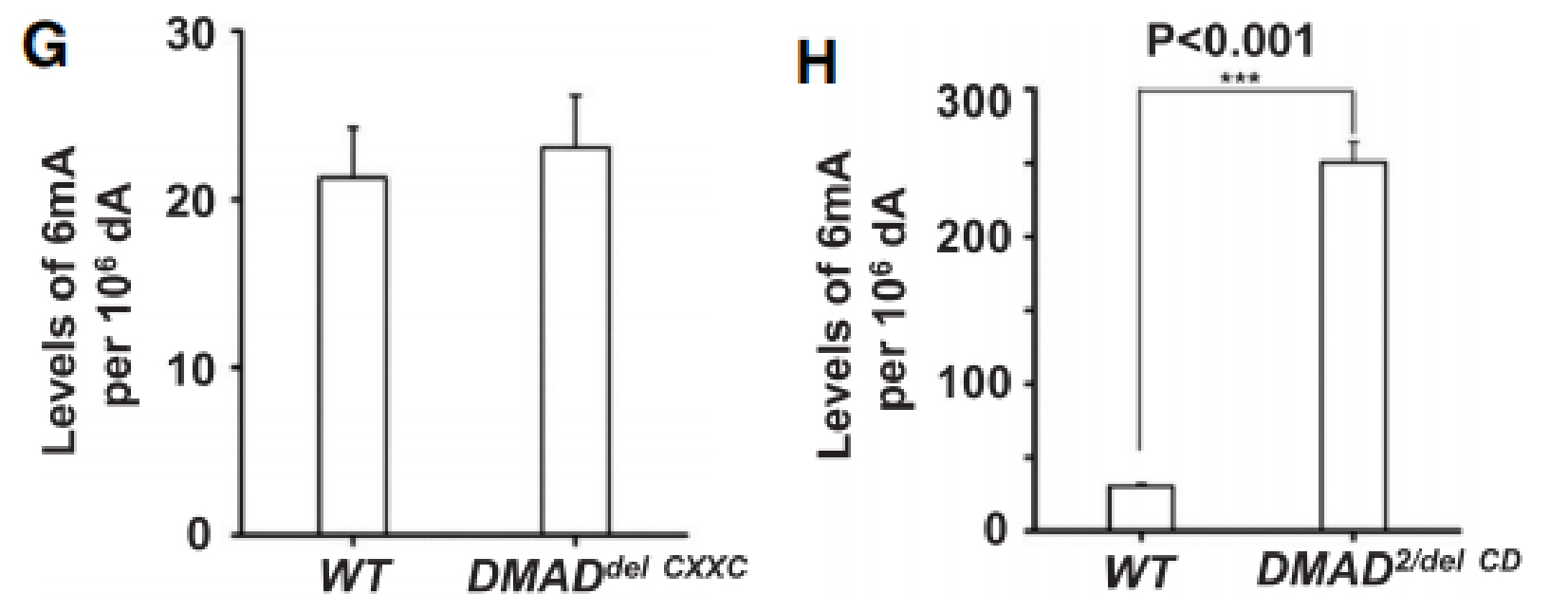
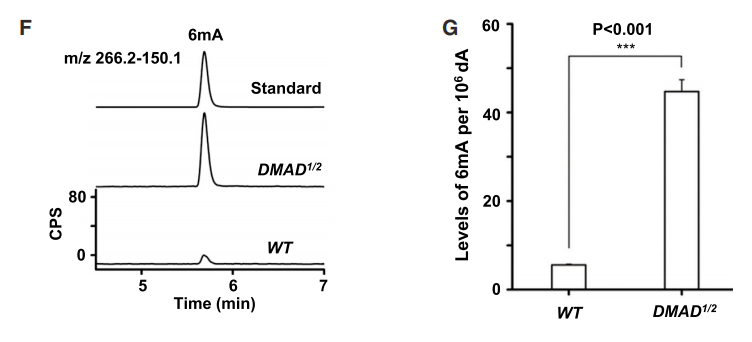
为了进一步确定DMAD在果蝇体内是否也可行使6mA去甲基化能力,作者检测了野生型、DMAD1/2果蝇体内6mA修饰的碱基比例,结果显示DMAD1/2果蝇中6mA占比远高于野生型(下图D)。
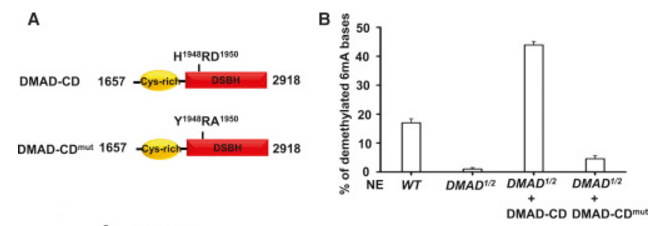
究竟是DMAD的哪个结构域在6mA去甲基化或果蝇生长发育过程中发挥重要作用呢?作者分别截断了DMAD蛋白的CXXC和CD结构域(下图F),结果显示只有DMADdel-CD中6mA占比明显升高,而DMADdel-CXXC无明显变化(下图G, H)。而且,DMADdel-CD回补无法挽救DMAD1/2致死表型,但DMADdel-CXXC可以(上图C)。这些均表明DMAD的CD结构域对果蝇的发育及其去甲基化能力发挥重要作用。
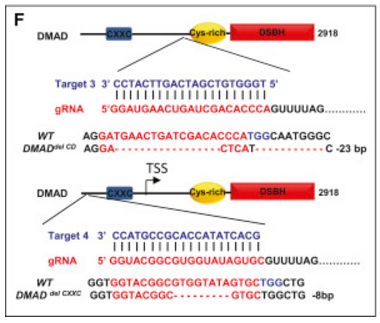
五、DMAD促进果蝇早期生殖细胞分化
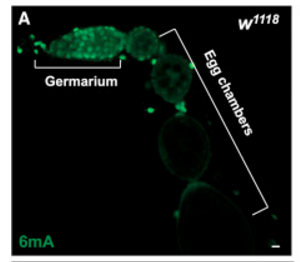
DMAD是否在生殖细胞中发挥作用呢?作者首先通过免疫染色查看果蝇卵巢中6mA修饰的整体情况(下图A),结果在原卵区(germarium)检测到极强的6mA信号,而在逐渐分化成熟的卵室(egg chambers)中,该信号随着发育逐渐减弱,表明生殖细胞中的6mA修饰可能可以调节其发育。
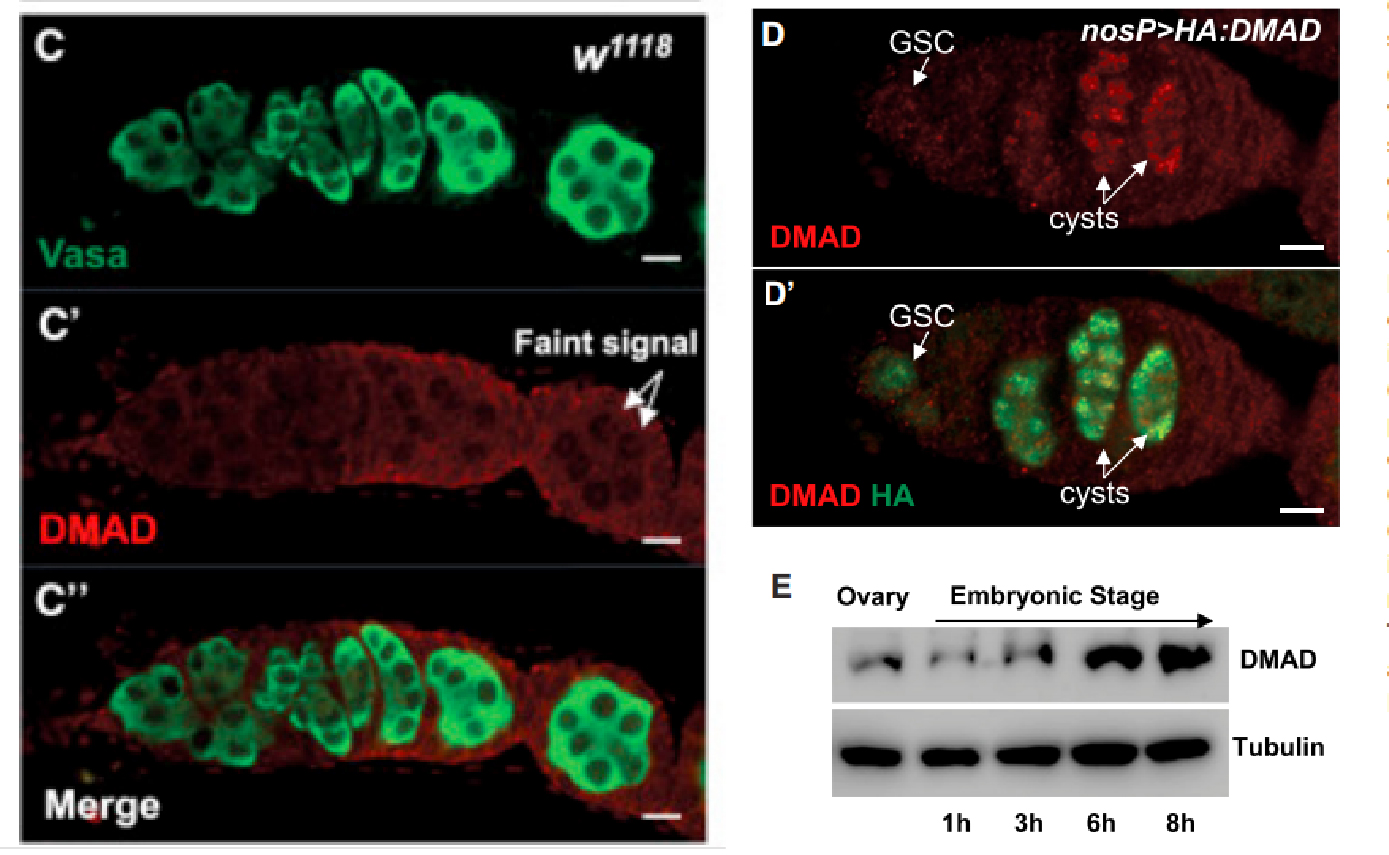
之后,作者检测了DMAD在卵巢中的表达情况,DMAD在生殖细胞中几乎不表达,但在卵室中有微弱的表达(下图C);此外,作者还检测了异源表达的DMAD-HA信号,结果显示生殖细胞中的HA信号很微弱(下图D)。与之一致的是,相较于胚胎,卵巢中的DMAD表达维持在低水平(下图E)。
DMAD同样可抑制果蝇卵巢中6mA修饰,在将其突变后,卵巢中6mA修饰显著升高(下图F、G)。
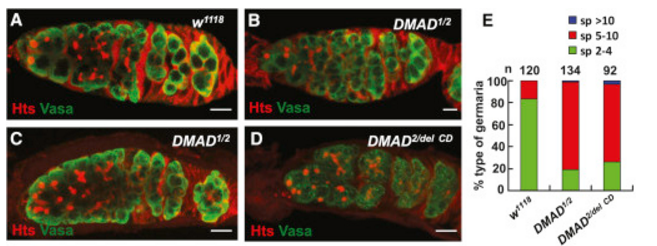
为了进一步探究DMAD调控的6mA修饰在果蝇早期生殖细胞发育过程中所发挥的作用,作者利用Vasa(用于观察生殖细胞)和Hts抗体(用于观察融合体)进行免疫染色,检查了果蝇卵巢中的生殖细胞状况(下图A-E)。野生型果蝇的卵原区通常含3-4个生殖干细胞(GSCs)/囊胚细胞(CBs),而DMAD1/2果蝇却有8个以上的类生殖干细胞(GSCs-like cells),表明DMAD可促进果蝇的早期生殖细胞的分化。
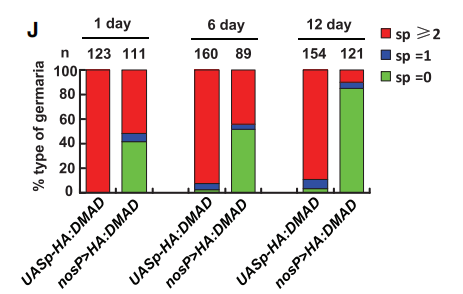
接下来,作者过表达DMAD,通过产生携带转基因组合P{UASp-HA:DMAD}和P{nosP-gal4:vp16}的果蝇来检测生殖细胞表型,其中nosP-gal4:vp16是生殖细胞特异性驱动的,结果表明DMAD过表达会使得包括GSCs在内的生殖细胞减少,进一步证实了DMAD可促进果蝇生殖细胞分化。
六、DMAD直接去甲基化6mA
为了进一步阐明DMAD的生化特性,作者使用野生型、DMAD突变体果蝇卵巢的核提取物进行体外去甲基化活力测定。结果显示,野生型果蝇卵巢核的提取物具一定去甲基化能力,而DMAD突变体基本丧失去甲基化能力,但回补DMAD的CD结构域后,其去甲基化能力增强(下图B)。此外,当DMAD的CD结构域被纯化后,可促进底物去甲基化(下图C)。这些均表明DMAD可直接对6mA去甲基化。
七、DMAD所介导的6mA去甲基化与转座子表达相关
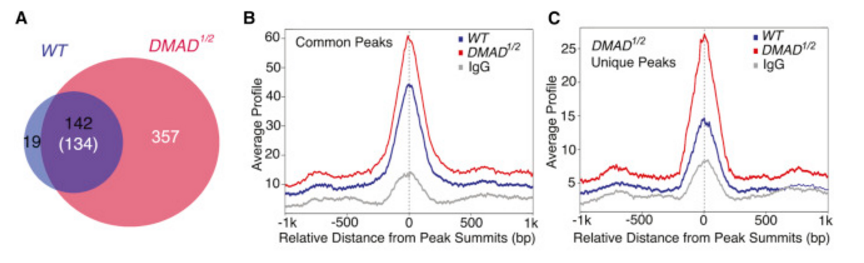
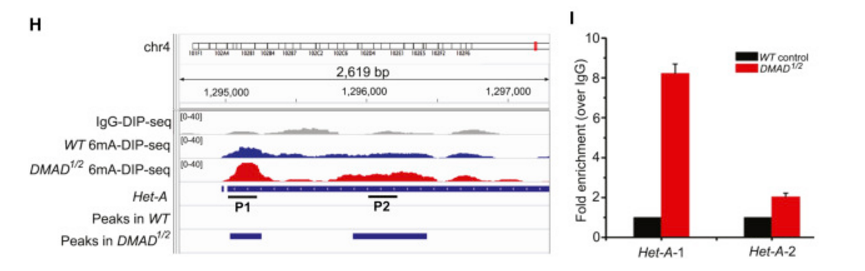
此后,作者对野生型、DMAD突变体果蝇进行了meDIP-seq,寻找果蝇基因组上具6mA修饰的区域,分别得到164、491个peaks(下图A),然而不论是两组共有peak还是DMAD突变体特有peak,DMAD突变体中的6mA信号强度均高于野生型(下图B, C)。
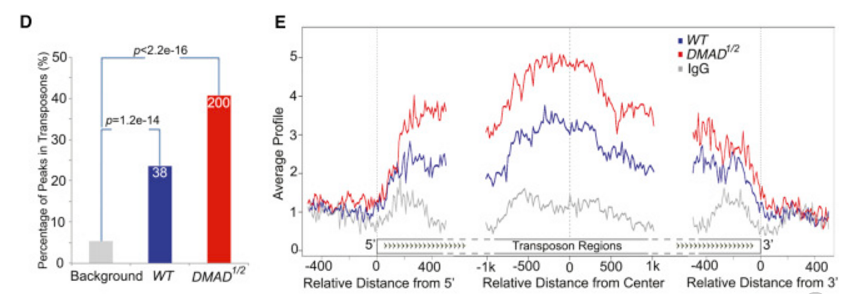
野生型、DMAD突变体果蝇中分别有24%、41% peaks落在转座子上(下图D),表明转座子是DMAD介导的6mA修饰重要靶点。相较于上下游区域,6mA修饰更倾向于发生在转座子的gene body上(下图E)。
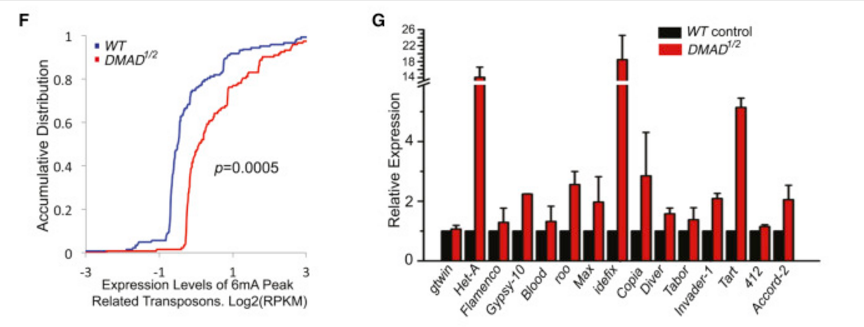
为了研究转座子区的6mA修饰情况是否调控其表达,作者又对野生型、DMAD突变体果蝇进行了RNA-seq,发现突变体中具6mA修饰区域的转座子表达水平远高于野生型(下图F)。qRT-PCR也显示,突变体中相关转座子的表达水平更高(下图G),表明DMAD可抑制相关转座子的表达。
meDIP-seq表明突变体中转座子的6mA修饰更多(下图H),meDIP-qPCR也证实了这一点(下图I)。这些结果表明,6mA甲基化与基因表达正相关。
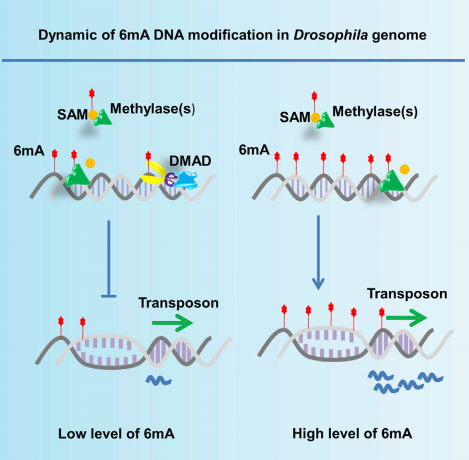
综上,作者得到一个简要模型:果蝇的胚胎发育过程中,基因组上的6mA修饰动态变化,这一过程依赖于去甲基化酶DMAD调控。DMAD直接对转座子区6mA去甲基化,从而抑制转座子的表达,调控果蝇的胚胎发育。
参考文献:
Zhang, G., Huang, H., Liu, D., Cheng, Y., Liu, X., Zhang, W., Yin, R., Zhang, D., Zhang, P., Liu, J., Li, C., Liu, B., Luo, Y., Zhu, Y., Zhang, N., He, S., He, C., Wang, H., & Chen, D. (2015). N6-methyladenine DNA modification in Drosophila. Cell, 161(4), 893–906. https://doi.org/10.1016/j.cell.2015.04.018



