
背景
基因表达的精准调控,对机体发育和细胞的各种生理功能的维持至关重要。转录是基因表达调控最关键的步骤,真核生物大多数基因的转录主要分为转录起始(initiation)、暂停(pausing)、延伸(elongation)和终止(termination)四个步骤,每个步骤都涉及到RNA聚合酶II(Pol II)与对应的转录因子之间的相互作用。
Pol II在转录起始后延伸到20-100 bp后暂停的现象被称为启动子近端Pol II暂停,这是转录调控的核心;该区域的稳定主要依赖于negative elongation factor (NELF),DRB sensitivity-inducing factor (DSIF)和Pol II-associated factor 1 (PAF1)等复合物来维持。Pol II暂停后,有“释放(productive release)”和“终止 (early termination)”两种后续。当激酶复合物p-TEFb被招募到暂停位点(pausing site, PS)后,它能磷酸化Pol II CTD、DSIF和NELF,使NELF解离,暂停的Pol II被DSIF等激活,从而进入高效延伸阶段(productive elongation)。
SPT5是唯一在所有生物中都保守的转录延伸因子,在多细胞生物中具有调控启动子近端Pol II暂停(promoter-proximal Pol II pausing)的功能。p-TEFb可介导SPT5的第666位点丝氨酸S666和其CTR1重复T806的磷酸化,而Integrator-PP2A (INTAC)可能做为SPT5的磷酸酶。激酶和磷酸酶如何拮抗SPT5的磷酸化状态,以及如何精确调控SPT5功能的?这些问题仍有待研究。
1.SPT5维持细胞和染色质Pol II蛋白水平
为了研究SPT5蛋白对基因转录直接的调控作用,作者利用CRISPR-Cas9系统构建了FKBP12F36V-SPT5(SPT5-dTAG)细胞系。dTAG(degradation tag)将CRBN泛素连接酶和FKBP12F36V连接起来,只要将FKBP12F36V与目标蛋白融合就能实现对其快速且特异的降解,从而可以对内源SPT5蛋白进行动态调控(如下图A)。如下图B和C所示,随着SPT5蛋白的降解,Pol II最大亚基RPB1减少。
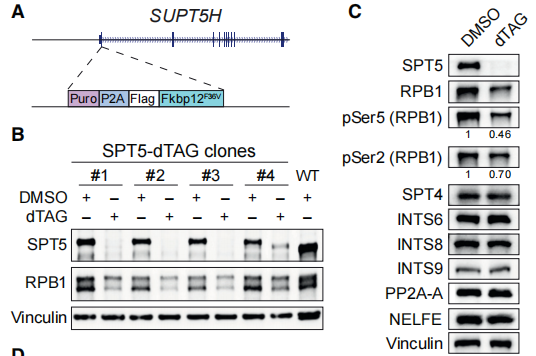
在转录过程中,Pol II可以处于起始、暂停和延长状态,这些状态受到不同分子的调控。作者进一步分别在代表性单基因(下图F)和全局Pol II谱(下图G)上发现,与gene body区域相比,启动子和增强子转录起始位点(TSS)周围Pol II分布下降得更显著。
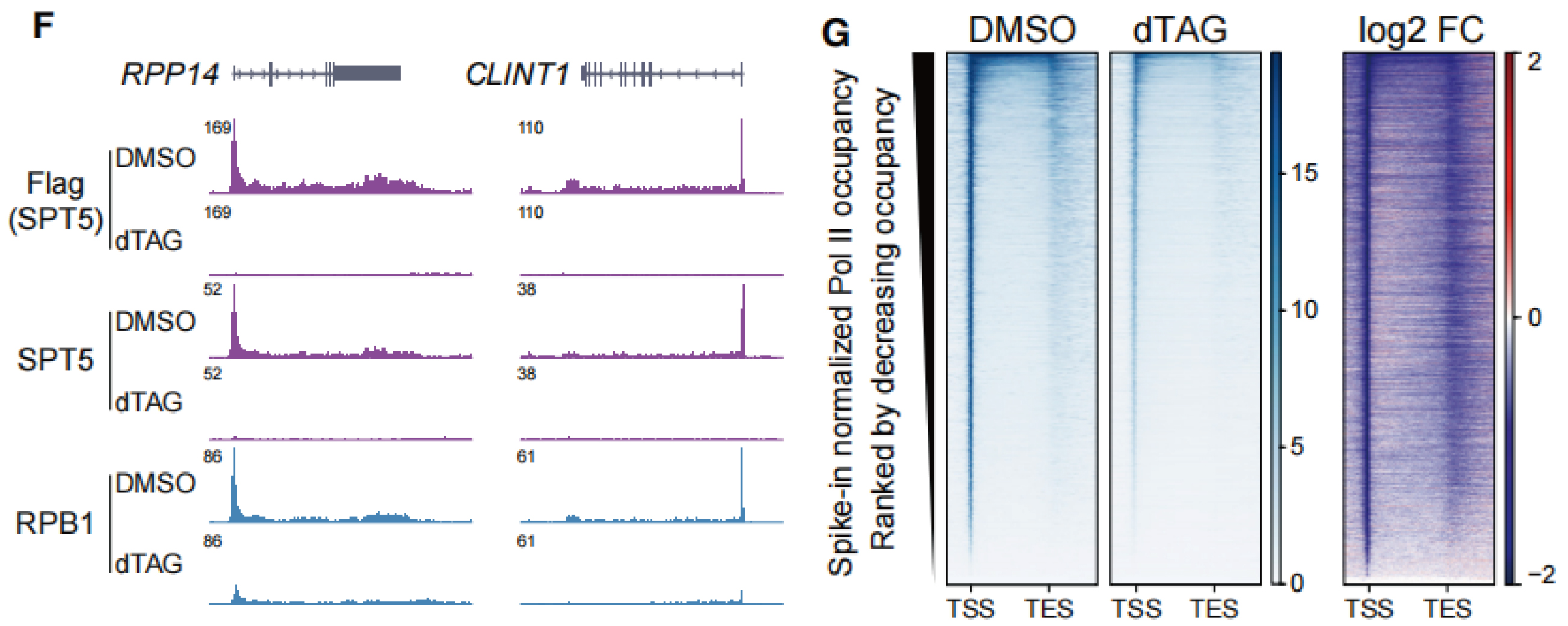
以上结果表明,SPT5对稳定Pol II的起始或暂停状态起着至关重要的作用。
2.SPT5稳定启动子上暂停状态的Pol II,并促进gene body区Pol II合成能力,从而促进整体转录
为了探究SPT5在调节转录中的直接作用,作者使用PRO-seq (Precision nuclear run-on sequencing) 技术来检测新生转录组。PRO-seq 技术是以单个碱基的分辨率检测转录Pol II的定位和转录活性的方法。PRO-seq技术分析SPT5蛋白快速降解的细胞,发现PS区的新生转录本大量减少,表明PS区Pol II大量减少;而处于gene body区的延长状态Pol II在有的基因上增加,有的基因上减少(下图A、B)。
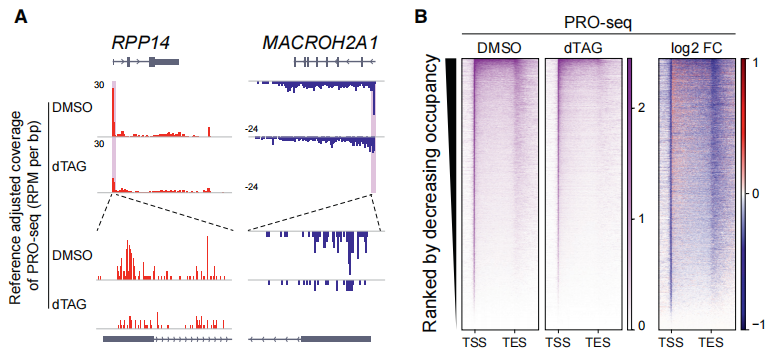
对于这些在gene body中PRO-seq信号增强的基因,原因可能是Pol II暂停释放增强,或延伸受阻,也可能两者兼有。增强的暂停释放会产生更多新生RNA,而延伸受阻会抑制新生RNA。为了区分这两种可能性,作者进行了TT-seq (transient transcriptome sequencing)。结果显示,SPT5的缺失导致了gene body TT-seq信号减少(下图F);统计TSS下游5kb窗口TT-seq信号,发现92.7%的基因新生RNA减少。这表明,延伸受阻可能是gene body区Pol II积累的主要原因。

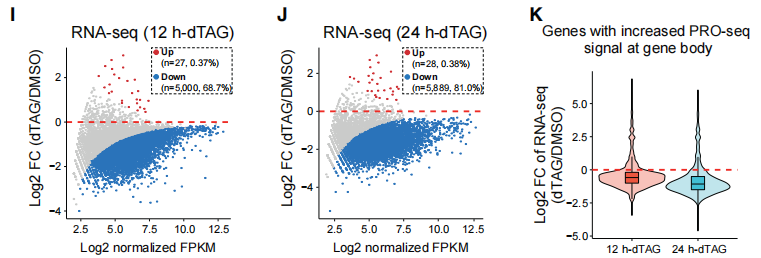
为了评估SPT5对成熟RNA水平的影响,作者在较长时间(12和24小时)dTAG处理的SPT5-dTAG细胞中进行了RNA-seq,以保证已经存在的成熟转录本的完成代谢。结果表明,下调基因远多于上调基因(下图I和J)。另外,即使gene body区PRO-seq信号增加的基因,其mRNA水平的降低也显而易见(下图K)。这些结果都表明SPT5是广谱正转录调控因子。
3.SPT5调控转录活性和增强子的染色质图谱
增强子(enhancer)能在时空上精确的调控靶基因的表达,其转录也依赖于Pol II。对PRO-seq信号的分析显示,在SPT5急性降解过程中,无论是正义还是反义转录了的增强子,Pol II从PSs延伸到下游区域的PRO-seq信号均大幅减少(下图A和B)。比较暂停窗口内的信号变化,发现启动子类似,增强子也有减少(下图C)。
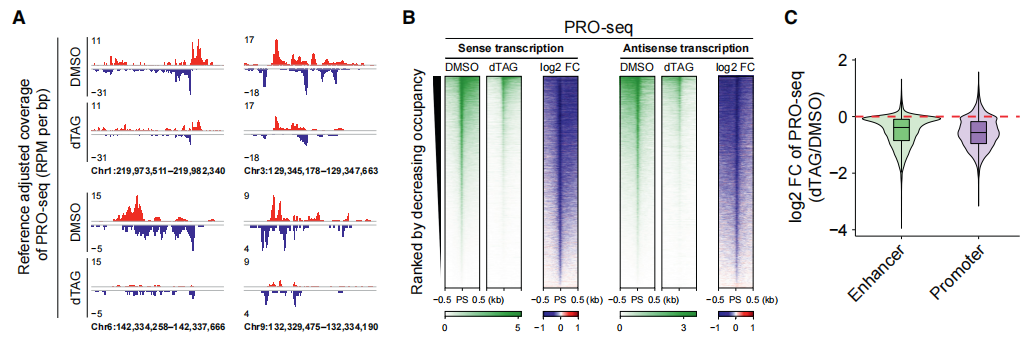
此前的研究表明,转录过程可以通过维持染色质的可及性、招募染色质修饰酶、调节长程染色质环化等途径重整染色质景观。为了研究SPT5缺失和相应的转录变化对染色质景观的影响,作者通过ATAC-seq发现 SPT5蛋白的缺失造成了约25%的增强子染色质可及性(chromatin accessibility)显著下降(下图D和E)。H3K27ac,MED1和BRG1(染色质重塑复合物BAF的催化亚基)的ChIP-seq结果表明,这些蛋白在增强子上的信号也减弱了(下图F)。
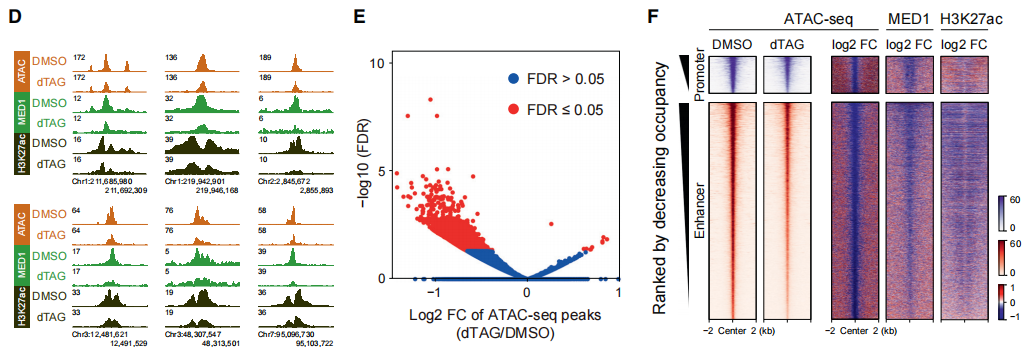
以上结果说明SPT5能调控增强子的转录活性和增强子的染色质图谱。
4.SPT5磷酸化在转录调控中的独特作用
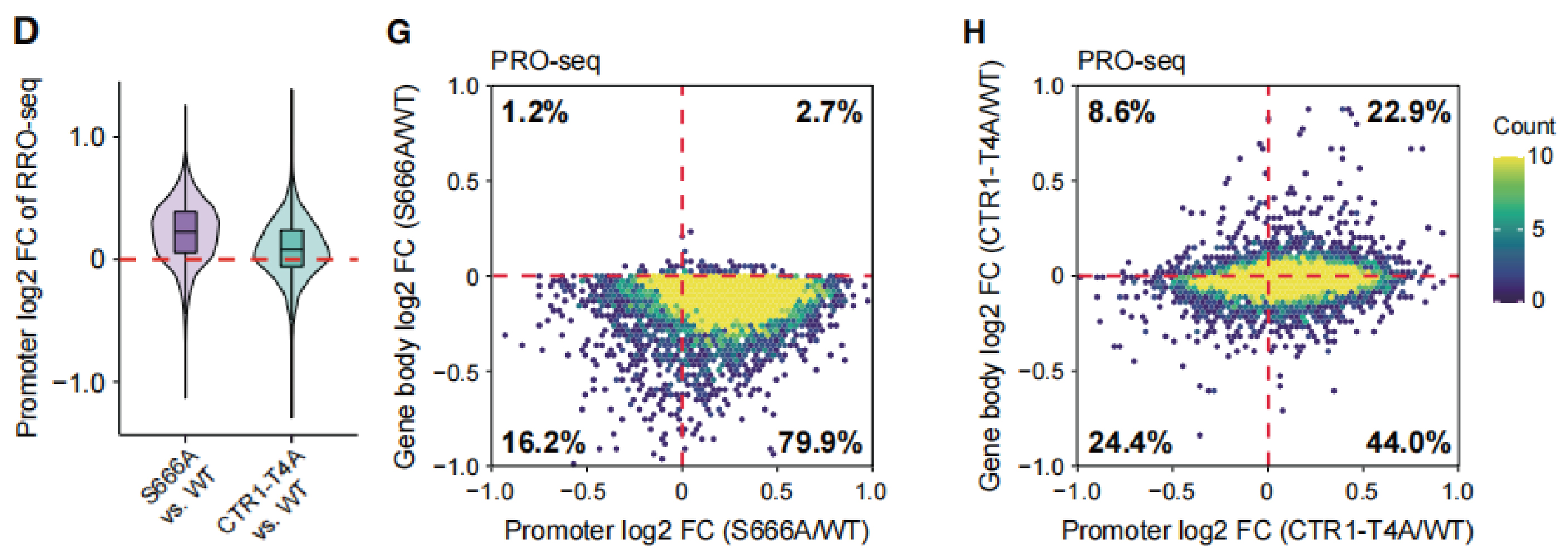
SPT5作为最保守的转录调节因子,激酶p-TEFb能磷酸化SPT5 S666和其CTR1重复第4位丝氨酸。这两个位点的磷酸化修饰是否影响SPT5稳定Pol II的功能呢?回补两个SPT5蛋白突变体(SPT5 S666A,SPT5 CTR1-T4A)至SPT5被dTAG降解的细胞中发现,两个突变体均能稳定Pol II(下图A),证明SPT5对Pol II的稳定不需要磷酸化。同时,野生型SPT5和两个突变体使PSs和启动子区的PRO-seq信号增强,SPT5 S666A作用在三者中最显著,提示SPT5 S666的磷酸化可能跟Pol II的暂停释放有关(下图B、C)。
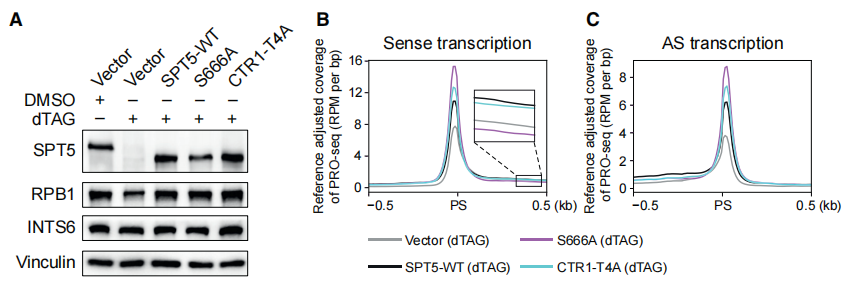
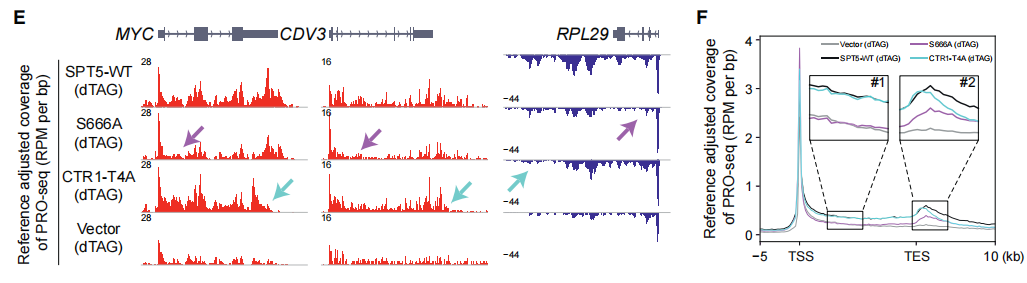
在暂停窗口内对PRO-seq信号进行量化,结果表明S666A回补引起的暂停Pol II水平显著增加,暗示Pol II暂停释放可能存在缺陷(下图D、E)。同时,S666A引起了从暂停窗口下游到基因末端的Pol II水平的显著降低(下图F)。二维密度图显示,S666A——而非CTR1-T4A——导致了~80%的基因的Pol II启动子占位升高、gene body占位降低(下图G、H),证实了Pol II暂停释放缺陷。
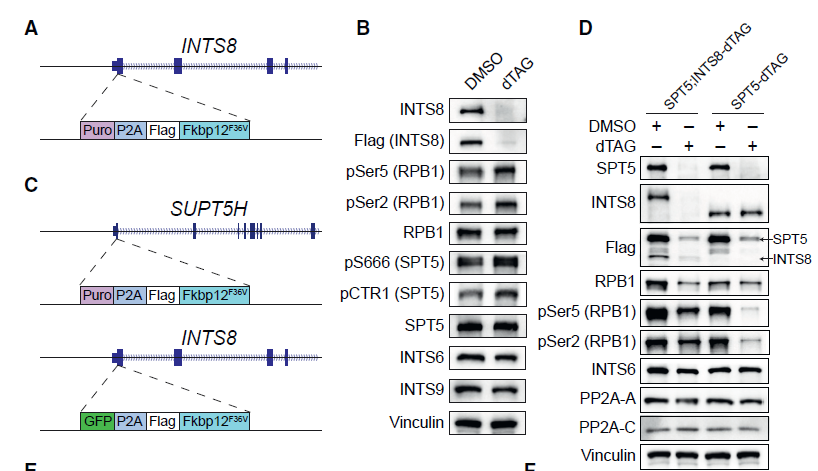
5. INTAC使SPT5脱磷酸化,但部分通过独立于SPT5的机制来调节转录暂停
INTAC复合物由Integrator和core PP2A组成,催化Pol II CTD和SPT5去磷酸化。此前研究表明,INTS8对连接core PP2A和Integrator至关重要。为了确定SPT5的哪个位点是INTAC的直接作用对象,作者构建了NTS8-dTAG细胞系(下图A)。通过WB实验发现,3小时dTAG处理导致S666和CTR1磷酸化的SPT5明显增加(下图B),表明SPT5的这两个位点可能都是INTAC磷酸酶的直接靶点,并提示INTAC在转录暂停和转录终止这两个阶段发挥着重要的作用。
那么,INTAC对SPT5去磷酸化在多大程度上影响了其转录调控呢?为此,作者构建了SPT5;INTS8- dTAG细胞系(下图C),能同时快速降解SPT5和INTS8。结果发现,尽管SPT5的缺失显著降低了Pol II的水平,但INTS8的缺失极大地升高了剩余Pol II的磷酸化水平(下图D)。
值得注意的是,INTS8缺失通过促进Pol II暂停释放,在一定程度上挽救了因SPT5缺失而导致的转录缺陷(下图E和F)。

SPT5和INTS8同时降解会导致gene body区Pol II占位升高(下图G),而此前单独降解SPT5则导致gene body区Pol II占位减少。直接比较gene body区的reads,额外缺失了INTS8,大多数基因的延伸Pol II能部分或全部恢复(下图H)。
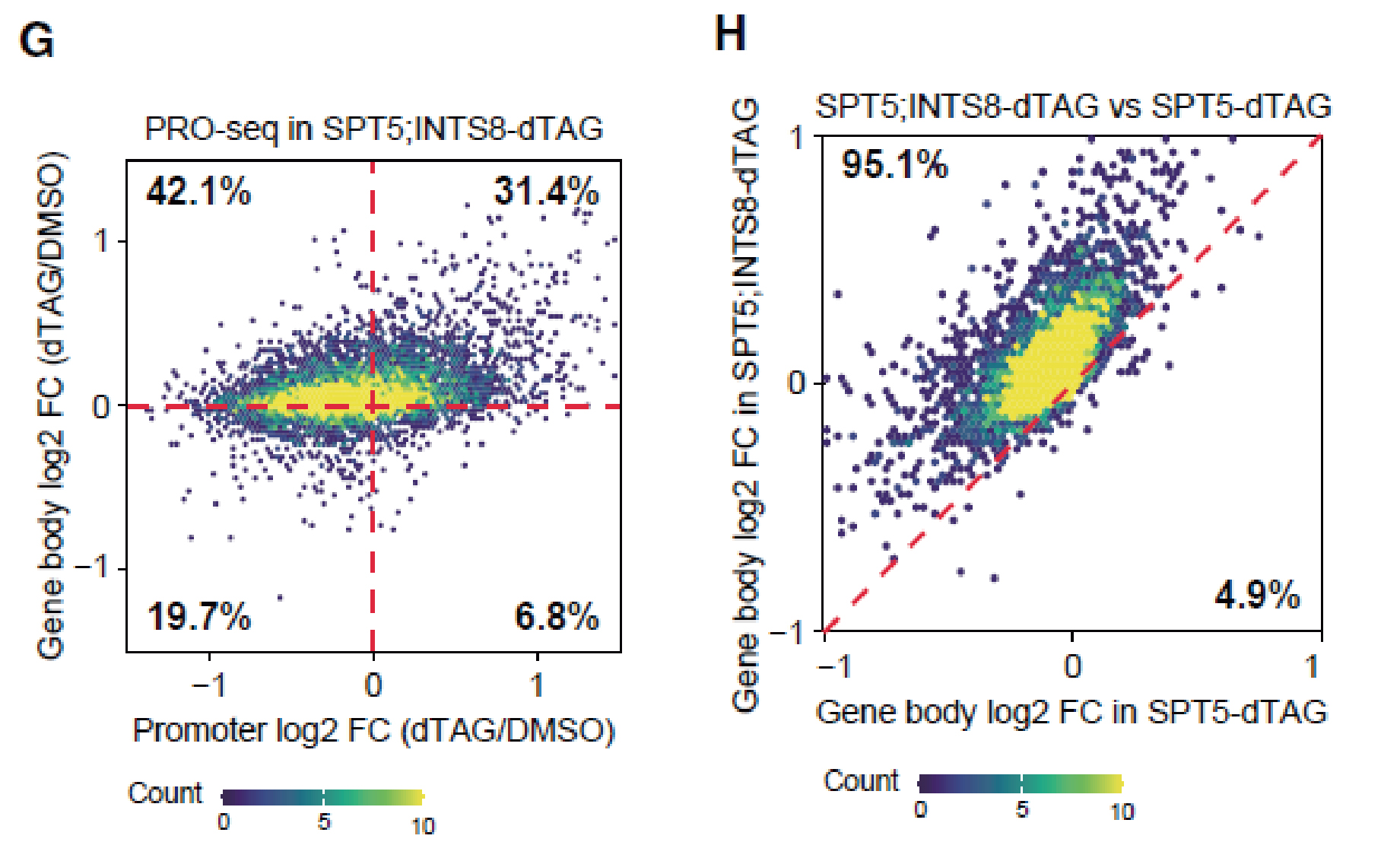
这些数据表明,在SPT5缺失的情况下,INTAC可能通过直接靶向Pol II或其他转录调控因子(如MYC)来调控Pol II的暂停和释放。
总结
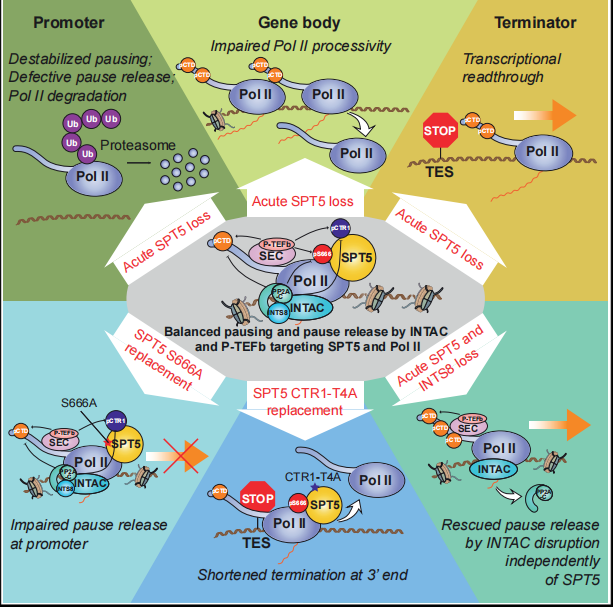
如图所示,通过使用dTAG快速降解系统,作者剖析了SPT5在人类细胞中调控转录的功能。SPT5除了在转录调控中发挥既定作用外,还在维持Pol II在细胞内和染色质上的水平方面发挥重要作用(下图A和B)。用多种组学方法研究发现,SPT5对转录的多个步骤具有复杂而独特的影响,SPT5缺失会导致其大部分靶基因表达量减少(下图B)。SPT5的S666和其CTR1区域第四位丝氨酸这两个磷酸化热点分别调控Pol II在5’端的暂停释放和3’端的转录终止(下图C)。INTAC复合物是SPT5磷酸酶,它也能通过靶向其它底物,如Pol II的CTD,发挥促进暂停释放的功能(下图D)。
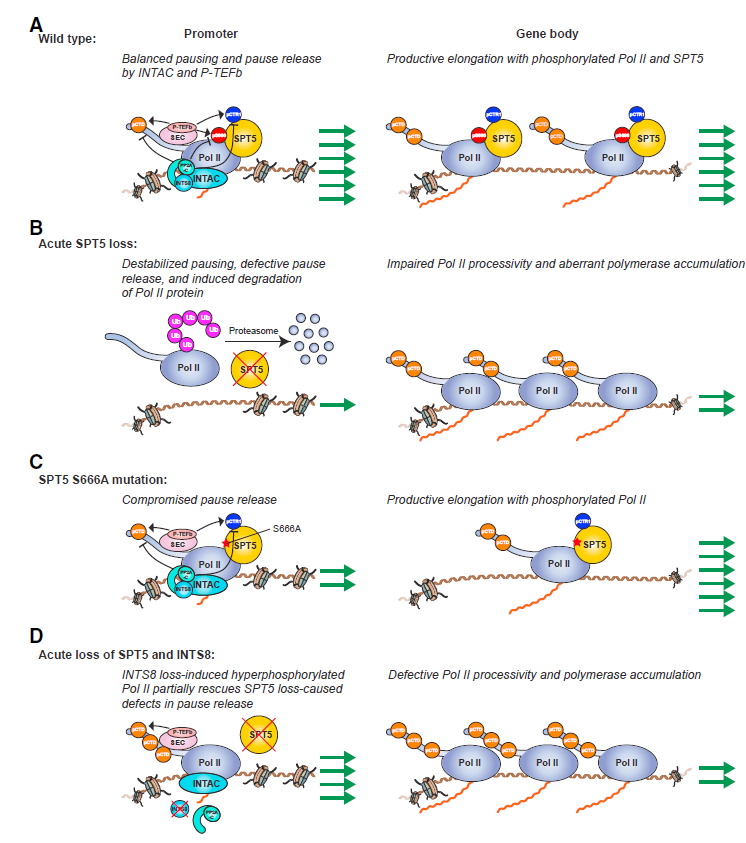
综上所述,本研究利用诱导型蛋白降解系统dTAG并结合高通量测序研究方法,发现转录调控因子SPT5能够稳定Pol II;在转录层面,SPT5能够调控增强子活性,稳定暂停状态的Pol II,并促进其释放、延伸和终止。其中,SPT5 S666的磷酸化特异性促进Pol II的暂停释放,而CTR1的磷酸化特异性调控转录终止。同时,这两个位点均能被磷酸酶复合物INTAC去磷酸化,说明了SPT5介导了INTAC的调控功能。SPT5蛋白影响增强子的转录活性、Pol II蛋白的稳定性、转录暂停、延伸和终止等环节,全方位调控转录核心机器的运转,为将来研究其生理病理的功能提供了理论指导。
参考文献:
Hu et al., SPT5 stabilizes RNA polymerase II, orchestrates transcription cycles, and maintains the enhancer landscape,Molecular Cell (2021), https://doi.org/10.1016/j.molcel.2021.08.029



