
研究背景和待解决的科学问题
在慢性病毒感染或者癌症发展过程中,CD8+ T细胞会逐渐变成功能异常的状态,即T细胞耗竭。近期研究发现耗竭T细胞池是由多个表型和功能不同的亚群组成,其中中等水平表达PD-1、高水平表达Ly108和CXCR5受体的Ly108+TCF-1+祖T细胞作为资源细胞群,在慢性病毒感染或者癌症发展过程中不断补充分化的Ly108- CX3CR1-终末耗竭T细胞。还有研究表明,在IL-21的存在下,某些Ly108+祖T细胞可以摆脱耗竭的命运,分化成CX3CR1+细胞毒效应T细胞。但是这些分化过程的机制尚不明确。
TCF-1转录因子是维持祖CD8+ T细胞干性的关键,某些同样重要的转录因子也被陆续鉴定出来,包括NR4A、EOMES、IRF4、NFAT、FOXO1、BLIMP-1和近期发现可以编程T细胞耗竭的TOX转录因子。
虽然对T细胞耗竭研究已经有很多成果,但CX3CR1+细胞毒效应T细胞究竟是如何被调控分化产生的呢?因此,本文需要解决的问题是:在CX3CR1+细胞毒效应T细胞分化过程中,转录水平和表观水平发生了什么变化?又有哪些重要的转录因子参与调控?
作者开展了以下研究。
研究内容
1. SCENIC分析揭示不同亚群间的转录调控回路
已有报道,在LCMV(lymphocytic choriomeningitis virus)的持续感染下,Ly108+ 祖T细胞(TPRO)、Ly108- CX3CR1-终末耗竭T细胞(TEXH)和CX3CR1+细胞毒效应T细胞(TEFF)等细胞群体的转录情况不尽相同。作者假定每个群体的分化都由不同的转录调控程序完成,并通过SCENIC(single-cell regulatory network inference and clustering)分析作者之前发表的三个类群的单细胞转录组数据。SCENIC根据表达模式,将转录因子及其潜在结合靶标定义为一个调节子(regulon),再将每个调节子在细胞中分为活跃或不活跃的状态,并作为细胞聚类标准,最终可以确定与细胞类型相关的关键基因调控网络(GRNs)。作者鉴定出27个在大部分细胞中活跃的调节子,如下图,其中黑色代表活跃,白色代表不活跃。
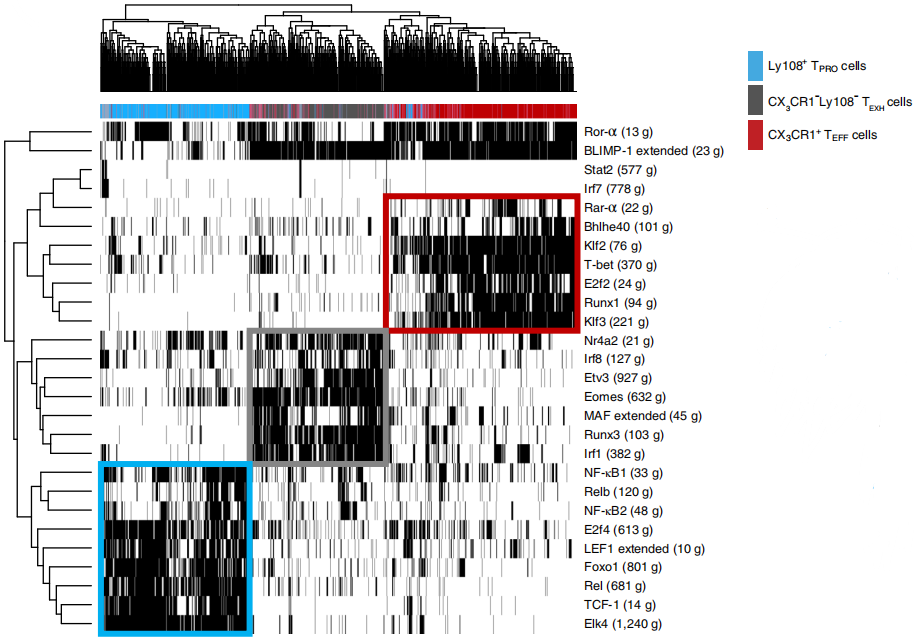
基于调节子活性的无监督细胞聚类(unsupervised cell clustering,无监督聚类是对数据实体的分类,只是在这个分类过程中,没有标签定义某实体应该属于哪一类,分类的准则实际上是数据实体本身的相似度)产生了三个不同的Clusters,这与根据细胞基因表达模式聚类的三个主要亚群(TPRO、TEXH和TEFF)密切相关,如下图。因此,TPRO、TEXH和TEFF细胞亚群在转录模式上有着显著区别,它们的分化过程由不同的GRN来调控。
TPRO细胞具有较高的TCF-1调节子的活性,TEXH细胞具有较高的NR4A家族转录因子以及EOMES调节子的活性,TEFF细胞展现出高水平的T-bet、BHLHE40、RUNX1、ROR-α、RAR-α、E2F2、KLF2和KLF3调节子的活性。在急性病毒感染过程中,T-bet(由Tbx21编码)可以单独或与ZEB2(由Zeb2编码)一起指导细胞毒效应T细胞的终末分化。
2. 在急性病毒感染中与慢性病毒感染中类似的CD8+T细胞群体
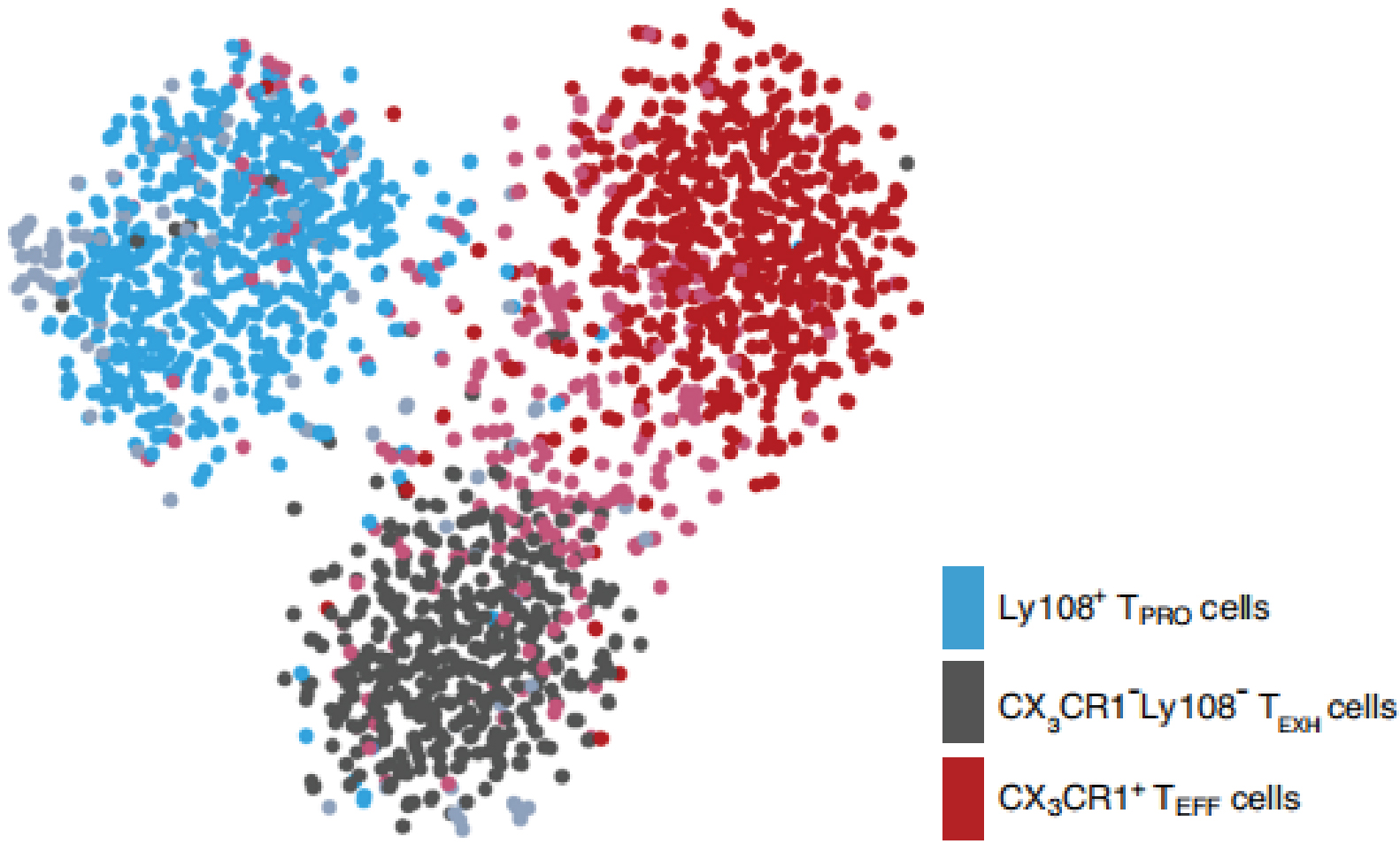
观察到TEFF细胞潜在的细胞毒性特征,作者假设TEFF细胞与KLRG1hi CD27lo短暂效应T细胞(short-lived effector cell, SLEC)可能相似。为了验证这一假设,作者分析了感染LCMV Cl13(慢性病毒)后30天和感染LCMV Armstrong(急性病毒)后9天的CD8+T细胞的单细胞转录组数据。无监督细胞聚类结果显示,SLEC细胞和TEFF细胞(均属于Cluster 0)可以聚在一起,如下图,说明两者相似。

接着作者对SLEC细胞和TEFF细胞基因表达情况进行比较,结果显示Cx3cr1表达水平在两者中相当;SLEC细胞具有更高的Klrg1表达水平,而TEFF细胞的颗粒酶B(GzmB)、干扰素-γ(IFN-γ)、肿瘤坏死因子(TNF)和T-bet表达水平更低。这些结果共同说明SLEC细胞和TEFF细胞的相似性,但是TEFF细胞也展现出为了适应慢性病毒感染而与SLEC细胞不同的特征。
3. T-bet调控TEFF细胞亚群的形成和功能
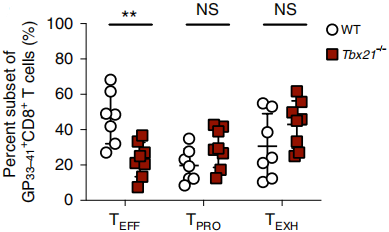
之前研究已经证明,T-bet调节子在急性病毒感染过程中调控SLEC的分化,那么在慢性病毒感染过程中T-bet调节子对TEFF细胞的形成和功能是否必要?作者构建了只在CD8+T细胞缺失Tbx21的BMC小鼠,发现TEFF细胞数量对比WT明显减少,如下图,说明T-bet对TEFF细胞的形成至关重要。
4. CD8+T细胞各个亚群具有完全不同的H3K4me3和H3K27me3修饰模式
既然CD8+T细胞各个亚群间表达模式明显不同,那么各个亚群的表观修饰情况如何呢?作者利用CUT&Tag-seq检测三个亚群细胞的H3K4me3和H3K27me3修饰情况,修饰在基因功能区的分布如下图所示。
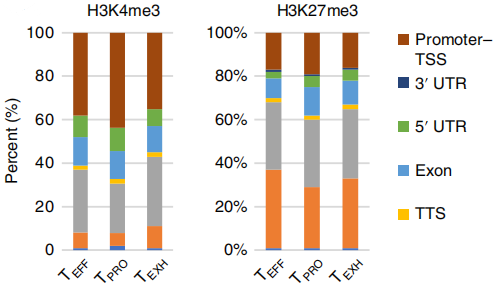
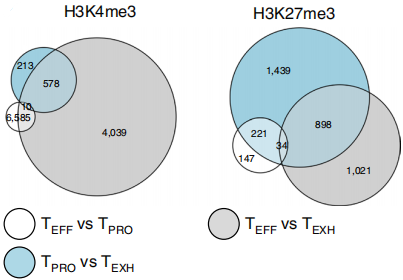
为了进一步确认三个亚群中修饰的变化情况,作者筛选出注释到Promoter-TSS区的peaks进行分析。通过三个亚群间两两比较,发现TEFF和TEXH细胞的H3K4me3修饰变化最显著(~93%),如下图左。至于H3K27me3修饰,TEXH细胞展现出独特的修饰模式。令人意外的是,TEFF和TPRO细胞的H3K4me3和H3K4me3修饰模式没有很大的区别,说明有其他的顺式调控原件在调控两者的表达模式。
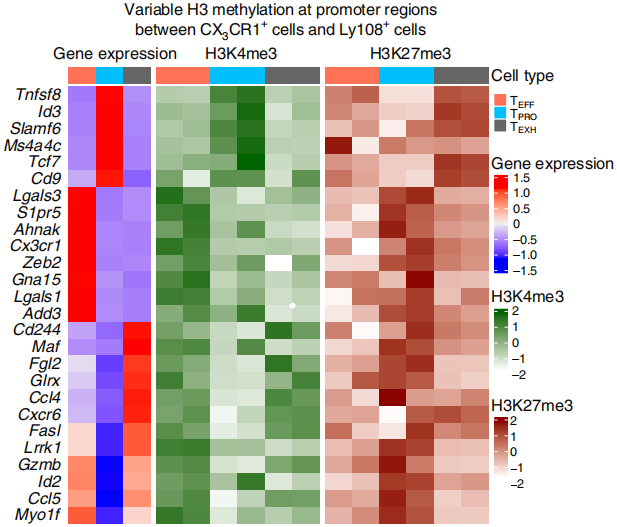
下一步,作者将CUT&Tag-seq和单细胞转录组数据进行联合分析,发现TPRO细胞的标志基因,比如Tcf7、Id3、Slamf6和Cd9一开始富集H3K4me3激活型修饰,但是随着TPRO细胞分化至TEFF和TEXH细胞后,这些基因上H3K27me3抑制型修饰水平逐渐升高,替代了原来H3K4me3修饰,如下图。同时,TEFF和TEXH细胞的Fasl、Gzmb和Ccl5基因H3K4me3修饰水平升高,以提高宿主的病毒数量控制能力。
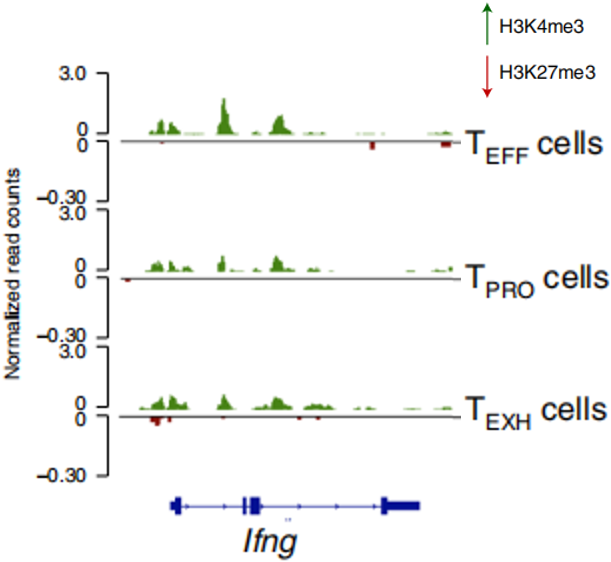
然而,TEXH细胞的Ifng基因座具有更高的H3K27me3修饰水平(如下图),而且IFN-γ的表达水平也比其它两个亚群更低。
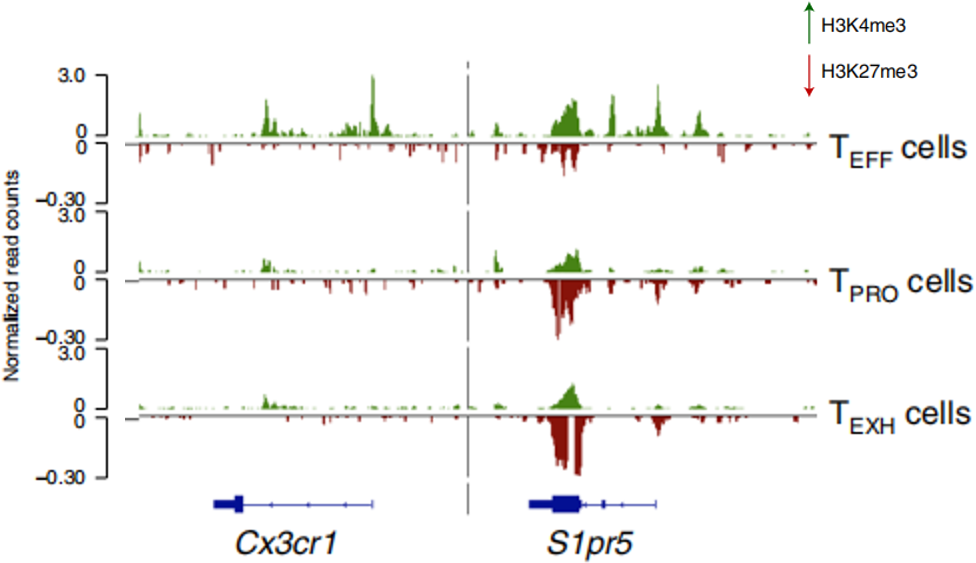
TPRO向TEFF细胞转化过程中,一些标志基因,包括Cx3cr1、S1pr5、Klrg1和Zeb2,随着基因座区域H3K27me3修饰水平的降低和H3K4me3修饰水平的升高,其转录逐渐被激活,如下图。这些结果说明TPRO向两个亚群分化时组蛋白修饰模式的变化调控了各个标志基因的表达。
在急性病毒感染过程中,新生CD8+T细胞中Tbx21和Eomes基因具有相同水平的H3K4me3和H3K27me3修饰,在转化成效应或记忆T细胞后,随着H3K27me3修饰水平下降,转录逐渐激活。而在慢性病毒感染过程中,Tbx21基因座一直保持较高的H3K4me3修饰,而且在三个亚群细胞中变化微小,但是Tbx21的表达水平在三个亚群中却有着显著区别,这暗示有其他顺式调控原件在发挥作用;与Tbx21情况不同,Emoes基因在TPRO和TEFF细胞中具有相同水平的H3K4me3和H3K27me3修饰,而在TEXH细胞中H3K4me3修饰水平较高,处于转录激活状态,如下图。

作者观察到,三个亚群中,大部分标志基因表观修饰变化会引起表达水平的变化,但是也存在组蛋白修饰无法解释的情况,因此将目光移向其它顺式调控原件,比如增强子。
5. 不同CD8+T细胞亚群中活性增强子分布情况完全不同
为了确定三个亚群增强子区域染色质开放情况,作者对三个亚群细胞进行了ATAC-seq,结果显示TPRO细胞染色质可及性区域最多,这与其干性有关;TEXH细胞有着最少的染色质可及性区域。在三个细胞亚群两两比较时,作者发现具有不同染色质可及性的区域主要定位于顺式作用原件,再加上SLEC细胞和TEFF细胞增强子染色质开放情况相似(如下图),推测增强子在亚群分化过程中起着重要作用。
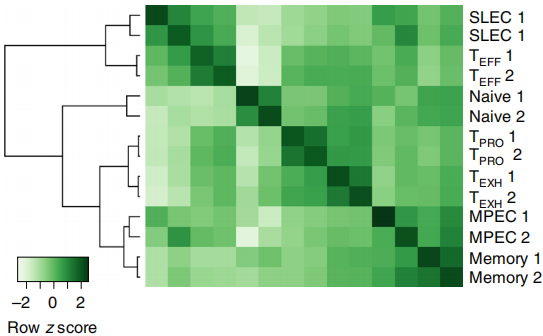
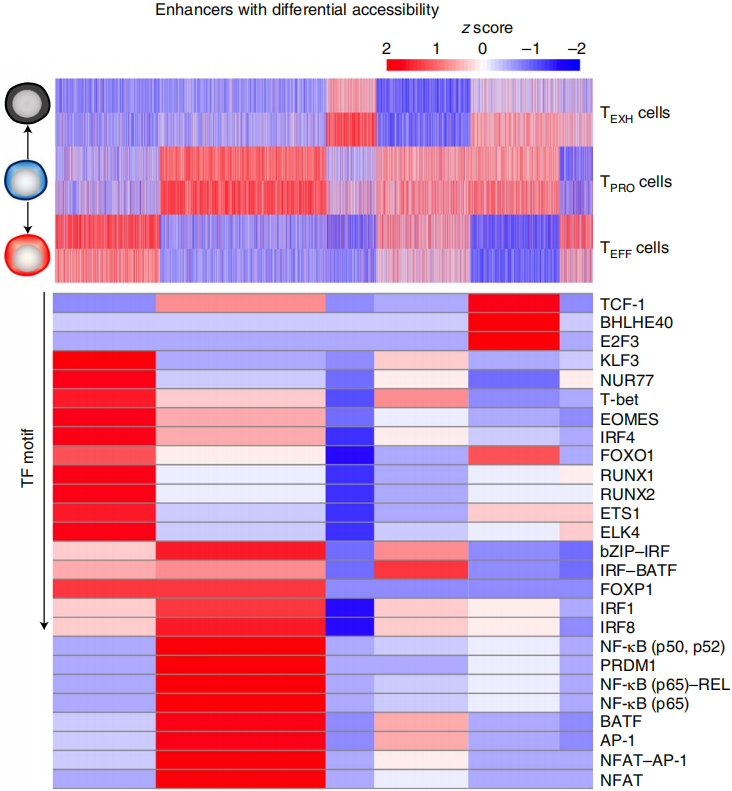
接着作者将三个亚群中染色质可及性不同的增强子区域进行分类,鉴定到6个在三个亚群中各自独有,或者两两共有的增强子区域,如下图上。为了确定这6个增强子区域的转录因子结合情况,作者利用HOMER扫描增强子区域的motif,如下图下。与SCENIC一致,在TEFF细胞增强子区域中,T-bet、RUNX1和KLF3的motif显著富集(下图下);TPRO细胞增强子区域富集TCF-1和NF-κB的motif(下图下)。之前有文献报道BATF-JUN复合物的motif在慢性病毒感染过程中的早期出现,最后在晚期消失;作者同样也观察到BATF的motif在TPRO和TEFF细胞的共有的增强子区域中显著富集,而TEXH细胞没有。这说明BATF在调控TEFF细胞分化方向和避免T细胞耗竭中起着重要作用。
6. BATF调控TPRO向TEFF转化过程
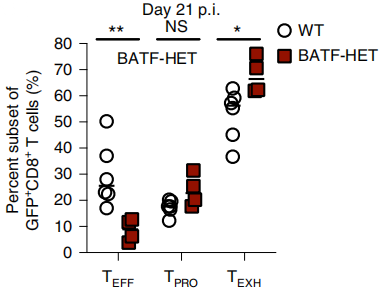
为了确定BATF在TPRO细胞向TEFF细胞转化过程是否必要,作者构建了敲除BATF后慢性病毒感染的小鼠模型,结果显示在感染21天后,TEFF细胞数量显著减少(如下图),TEXH细胞数量显著增加,这说明BATF在TPRO细胞向TEFF细胞转化过程中的重要性。
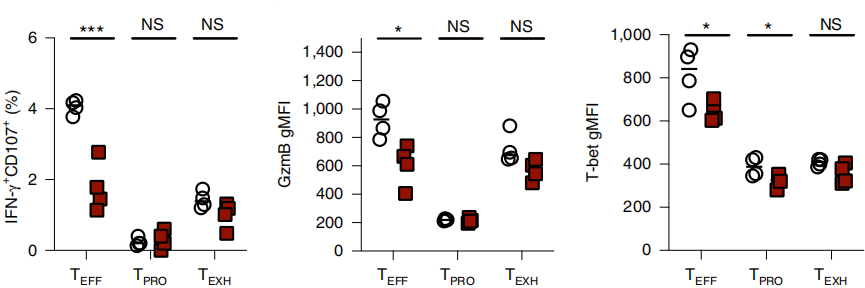
BATF缺失后,TEFF细胞中IFN-γ、GzmB、KLRG1和T-bet表达水平显著降低(如下图),最终导致病毒数量控制失败。
那么BATF到底通过什么来调控TPRO细胞向TEFF细胞转化过程呢?
7. BATF调控TEFF形成过程中增强子染色质可及性
基于BATF转录因子的特性,BATF是否通过调节增强子区域染色质可及性导致三个细胞亚群的增强子分布差异呢?作者对感染慢性病毒28天后的WT、缺失BATF小鼠模型(BATF-HET)、敲除BATF后LCMV感染特有的CD8+ T细胞进行ATAC-seq。结果显示,对比WT,BATF-HET和敲除BATF后特有的CD8+T细胞丢失了3918和4583个增强子区域的peaks,这些增强子大部分定位于TEFF细胞分化相关的基因,例如Cx3cr1、Gzmb、Ifng等,说明BATF可以调控与TEFF细胞功能相关基因染色质的可及性。
为了得到BATF具体结合的位点,作者下一步对BATF进行CUT&Tag-seq,结果显示在三个亚群中TEFF细胞有着最多BATF结合的peak(如下图)。
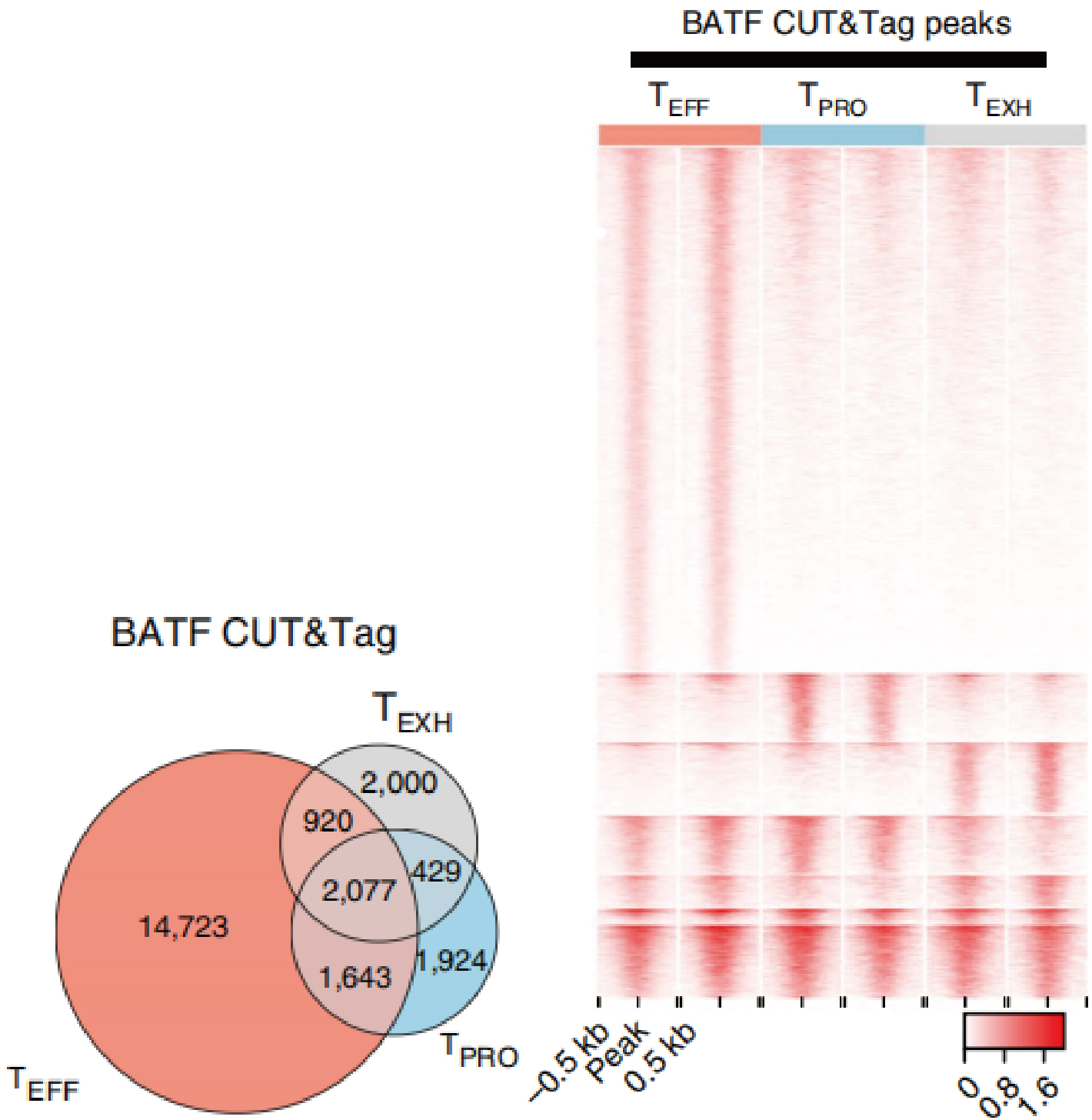
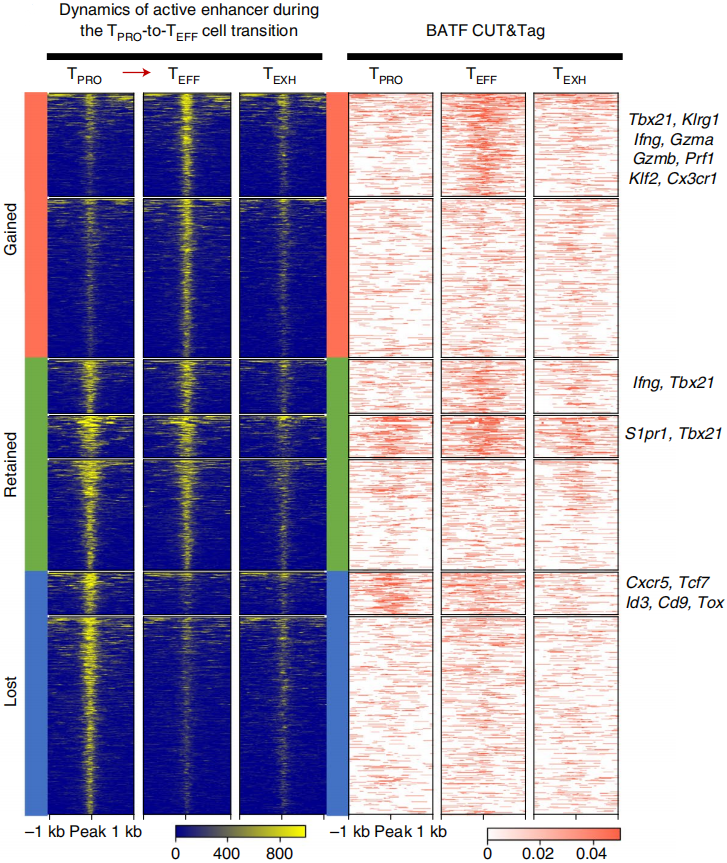
为了确认分化过程中BATF在活跃增强子区域的结合位点,作者首先将TPRO细胞和TEFF细胞的活跃增强子区域中同时具有H3K27ac和ATAC信号(peaks)筛选出来,接着将这些增强子区域基于他们在各自细胞分布情况进行无监督聚类,主要聚成三大类:a. 分化过程中TEFF细胞获得活性的增强子区域(Gained);b. 分化过程中TEFF细胞保留活性的增强子区域(Retained);c. 分化过程中TEFF细胞失去活性的增强子区域(Lost);如下图左。在得到这些区域后,作者接下来寻找这些区域中BATF的结合位点:首先,BATF在分化过程中结合了39%获得活性的增强子区域,45%保留活性的增强子区域,如下图右;这些活性增强子区域附近的基因均为效应T细胞功能相关基因,包括Klrg1、Ifng、Gzmb、Tbx21、Klf2和Cx3cr1等。而在TPRO细胞中,BATF主要结合TPRO细胞标志基因附近的增强子区域,例如Cxcr5、Tcf7、Id3、Cd9和Tox,伴随分化过程,这些增强子逐渐失去活性(如下图左)。
通过进一步分析,作者发现BATF选择性结合在Tbx21转录起始位点(TSS)下游2.4 kb处和上游12 kb增强子区域,以及Klf2上游远端增强子区域,如下图上绿色阴影部分,而且这些增强子在TEXH细胞中并不活跃。另外,BATF还单独结合在TEFF细胞中Tbx21上游8.2 kb和18 kb增强子区域(下图上),以及Cx3cr1的增强子区域(下图下)。
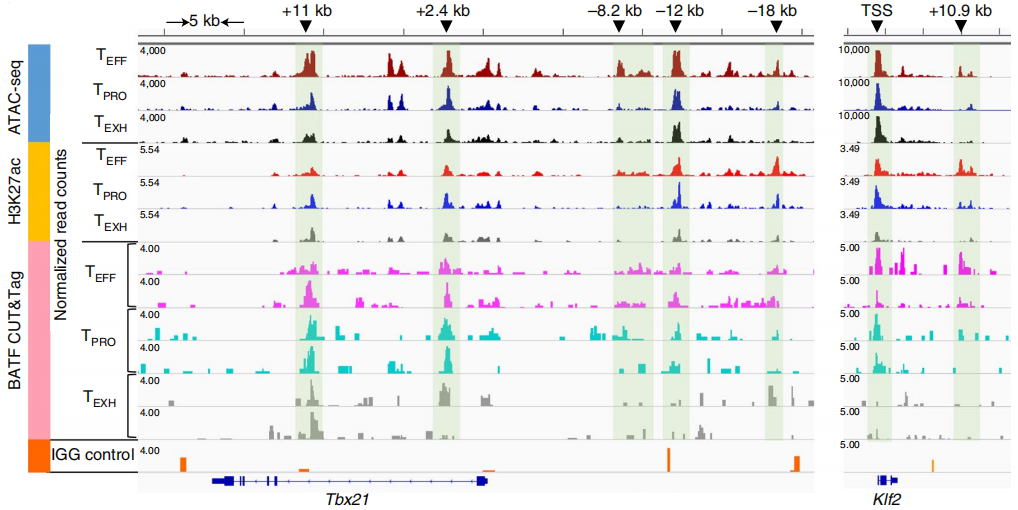
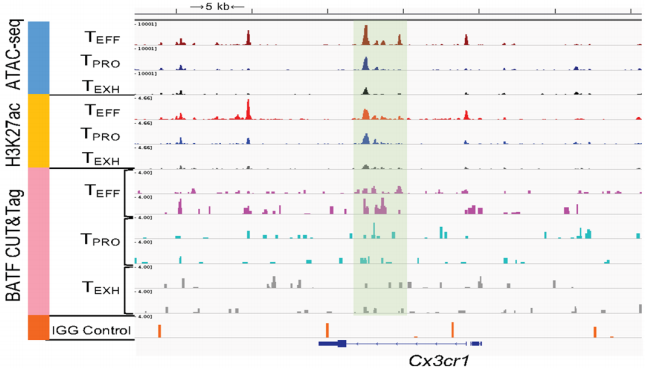
这些结果共同说明BATF可以调节相关增强子的染色质可及性来促进TPRO细胞向TEFF细胞转化过程。
总结
1. 利用SCENIC分析慢性病毒感染产生的三种CD8+T细胞单细胞转录组数据,得到无监督细胞聚类结果,发现三种CD8+T细胞亚群表达模式和表观景观显著不同;
2. 将数据库中急性病毒感染中短暂细胞毒效应T细胞(SLEC)单细胞转录组数据与慢性病毒感染中类似细胞毒效应T细胞(TEFF)数据比较,证明两者具有相似性;
3. 根据急性病毒感染的研究,作者构建Tbx21基因缺失的CD8+T细胞小鼠模型,证明T-bet调控TEFF细胞亚群的形成和功能;
4. 检测完表达模式后,利用组蛋白CUT&Tag-seq,作者检测了三个细胞亚群的H3K27me3和H3K4me3的修饰水平,通过组蛋白修饰水平可以解释三个细胞亚群大部分转录水平的变化,但是发现还存在其他调控机制;
5. 为了进一步解释转录水平的变化,作者利用ATAC-seq检测活性增强子在三个细胞亚群中的分布情况,并在TPRO细胞和TEFF细胞活性增强子区域中鉴定到BATF转录因子的motif;
6. 构建敲除BATF后感染慢性病毒小鼠模型,TEFF细胞数量显著减少,证明BATF参与调控TPRO向TEFF转化过程;
7. 再次利用ATAC-seq、BATF的CUT&Tag-seq,作者证明BATF可以通过调节增强子的染色质可及性来调控TPRO向TEFF转化过程。



