
由S. sclerotiorum引起的核盘菌茎腐病(SSR)在世界范围内对油菜籽(Brassica napus L.)造成了毁灭性的经济损失。核盘菌低毒相关DNA病毒1(SsHADV-1)是一种环状单链DNA病毒,SsHADV-1的感染能导致其宿主核盘菌DT-8毒力低下、生长速度降低和其他菌落形态变化。然而,SsHADV-1导致菌核菌毒力下降的机制仍不清楚。本研究中,作者利用康测科技unique molecular identity RNA-seq (特异性分子标签转录组测序,以下简称UMI RNA-seq,/list/10.html)进行转录组分析,以阐明DT-8响应SsHADV-1感染的内在机制。那么作者是如何通过转录组测序来揭示这一过程呢?让我们跟随小编的脚步来领略吧~
研究思路
1. 转录组数据总览
首先,作者对携带SsHADV-1的核盘菌低毒株DT-8和无毒菌株DT-8VF样本分别进行了UMI RNA-seq。结果表明,与菌株DT-8VF的基因表达数据相比,在菌株DT-8中总共发现了3110个具有统计学意义的差异基因(differential expressed gene,以下简称DEG),其中1741个上调,1369个下调(图1)。接下来,作者就通过对这些DEG进行功能分析来阐释DT-8内在的响应机制。

2. DEG的GO富集分析
作者发现,上调的1741个基因显著富集到22个GO terms中(图2a)。其中9个terms与DNA复制和DNA修复有关。此外,“碳水化合物跨膜转运”、“碳水化合物:质子同向转运蛋白活性”和“糖跨膜转运蛋白活性”也显著富集。这些结果表明,SsHADV-1的感染可能激活了菌株DT-8的DNA损伤反应并增强其碳水化合物获取。
另外,下调的1369个基因显著富集到10个GO terms中(图2b),其中三个terms与核糖体的结构和功能有关,即“核糖体亚基”、“胞质核糖体”和“核糖体结构成分”。同时,“翻译”相关terms以及两个与碳水化合物代谢相关的GO terms,即“碳水化合物结合”和“碳水化合物代谢过程”也被显著富集。这些terms可能与菌株DT-8的生长减弱有关。
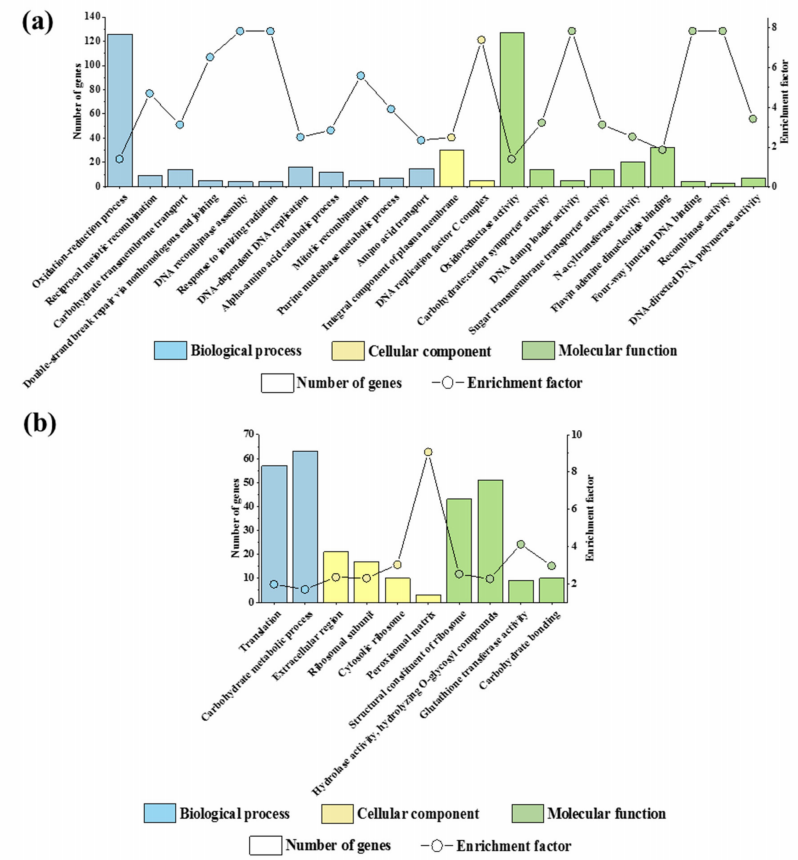
图2
3. DEG的KEGG富集分析
上调DEG的KEGG富集分析显示出与GO富集分析相似的结果。对于1741个上调基因,显著富集的12条terms中有8条terms与DNA复制和DNA修复有关(图3a),再次表明SsHADV-1的感染可能激活了菌株DT-8的DNA损伤反应。
对于下调基因,也与GO富集分析类似,“碳水化合物代谢”、“淀粉和蔗糖代谢”、“核糖体”、“翻译”和“翻译因子”是KEGG富集的terms。此外,“脂质生物合成蛋白”也被富集(图3b)。这些途径也可能与菌株 DT-8的生长减弱有关。
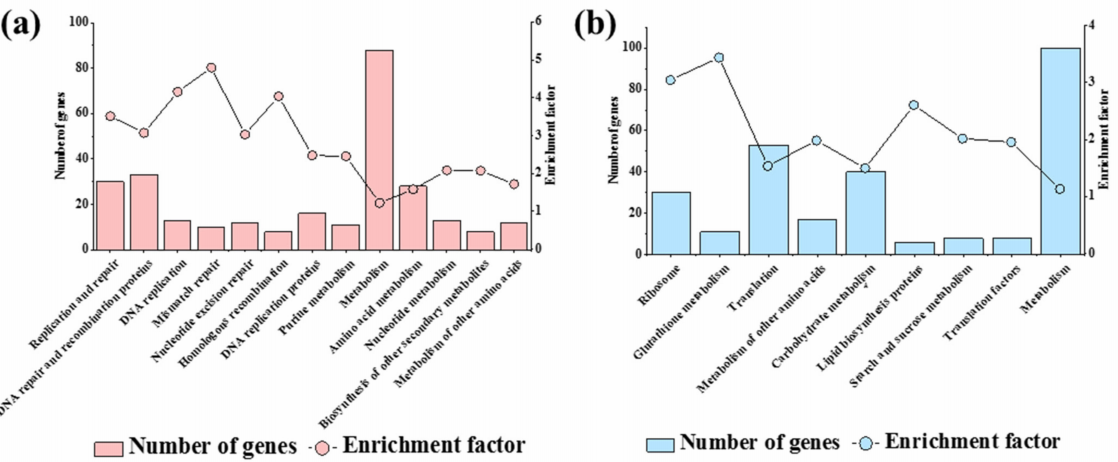
图3
4. 菌株DT-8中关键的非同源末端连接(NHEJ)基因上调
在核盘菌基因组中,有2个Ku70/Ku80同源物(ssKu70,SS1G_02717;ssKu80,SS1G_07128)、1种DNA修复蛋白XRCC4(SS1G_02074)和1种DNA连接酶4(SS1G_03342)。Ku70-Ku80是一种异源二聚体蛋白,能与DNA结合,与DNA修复蛋白XRCC4和DNA连接酶 4形成复合物,激活NHEJ途径以修复DNA双链断裂。与菌株DT-8VF相比,所有关键NHEJ基因在菌株DT-8中均上调(图4)。 该结果表明SsHADV-1的感染激活了菌株DT-8中的NHEJ途径。

图4
5. 大多数抗病毒RNA沉默基因在DT-8菌株中被下调
RNA沉默被认为是一种针对外来核酸的适应性防御机制,广泛存在于动物、真菌和植物病毒。在核盘菌基因组中,有2个Dicer样(Dcl)基因、2个argonaute样(Agl)基因和3个RNA依赖性RNA聚合酶(RDR)基因。与菌株DT-8VF相比,除SsSDcl1(SS1G_13747)外,其他抗病毒RNA沉默基因在菌株DT-8中下调(图5)。这表明SsHADV-1可能抑制了宿主抗病毒RNA沉默从而得以在菌株DT-8中存活。
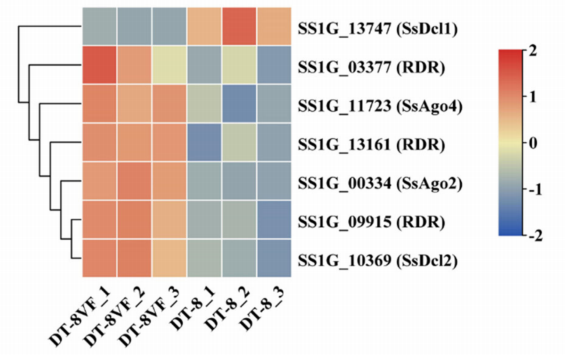
图5
6. SsHADV-1感染下调DT-8中毒力因子基因的表达
目前,核盘菌致病机制的研究主要集中在植物细胞壁降解酶(PCWDE)、毒力相关分泌蛋白和草酸(OA)上。在鉴定到的植物细胞壁降解酶(PCWDE)基因和效应子样小分泌蛋白中,Sspg2、Sspg1、Sspg3、Endo2、Ssv263、SSITL和Ss-rhs1在菌株DT-8中下调(图6a、b)。与对照菌株DT-8VF相比,除阳性转录因子基因Ss-Pac1外,草酸(OA)生物合成关键基因(Ss-Oah1、Ss-Pth2和Ss-Mls1)和降解关键基因(Ss-odc2)在菌株DT-8中均呈下调(图6c)。 这表明SsHADV-1的感染可能全面抑制了菌株DT-8的OA代谢。
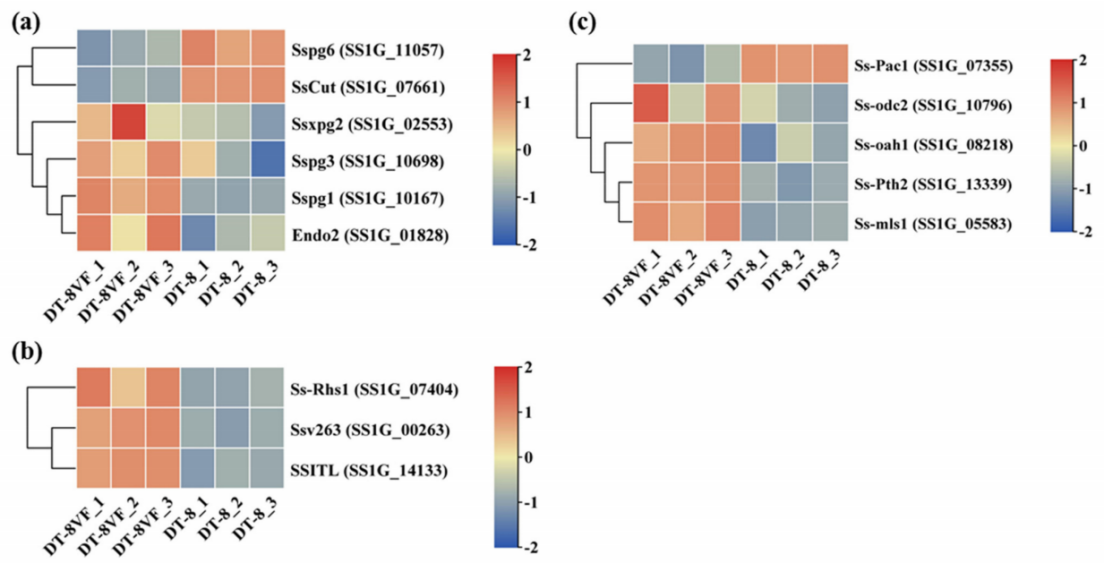
图6
7. qRT-PCR 验证基因表达
为了验证UMI RNA-seq中获得的结果,作者通过qRT-PCR分析了部分核盘菌基因的相对表达水平。结果显示这些代表性基因的表达模式与转录组测序数据一致(图7),表明了转录组测序的可靠性。
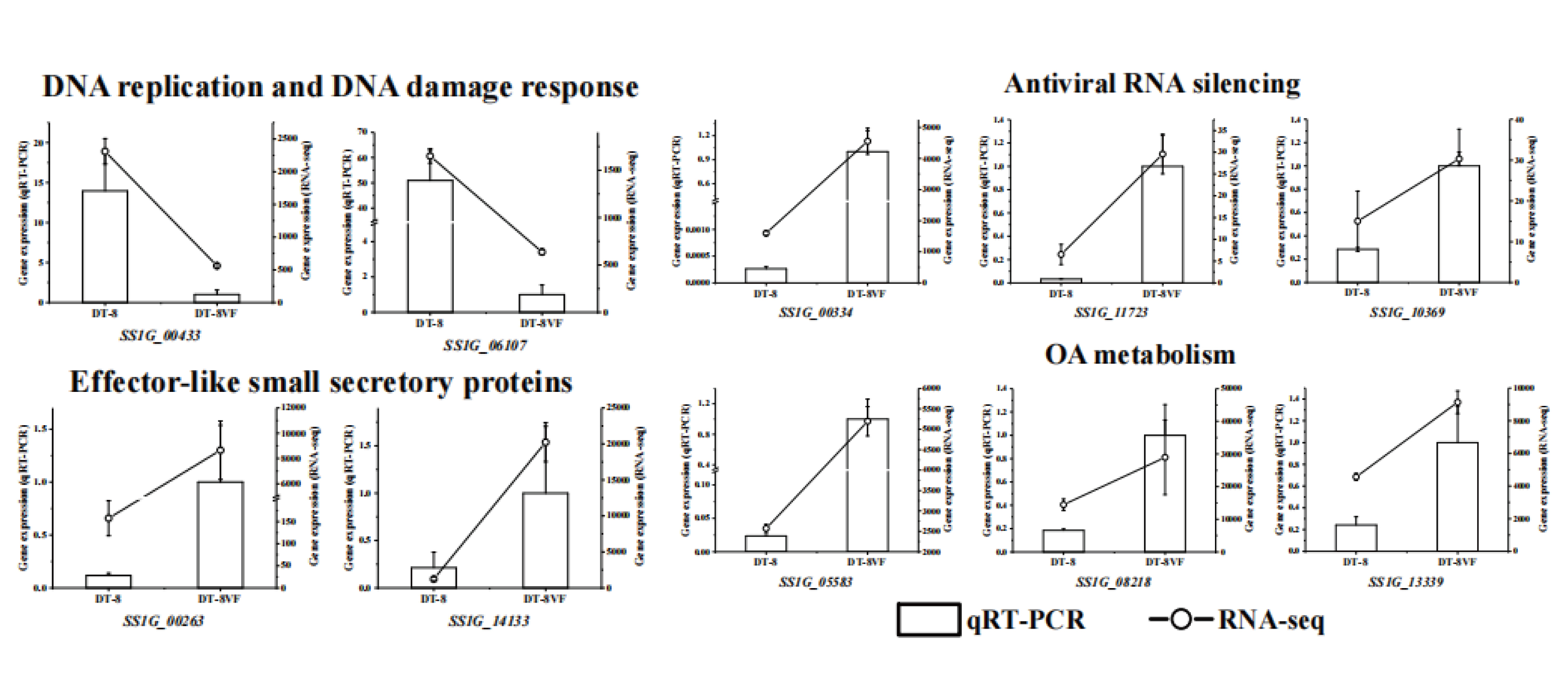
图7
总结
在本研究中,作者利用UMI RNA-seq研究了SsHADV-1感染对核盘菌全基因组转录的影响。通过比较分析菌株DT-8与DT-8VF的基因表达谱,作者发现SsHADV-1感染下调了DT-8中参与碳水化合物、脂质代谢、核糖体组装、翻译和毒力因子相关基因的表达,这可能与菌株DT-8的生长减缓和低毒力有关。此外,SsHADV-1的感染还抑制了宿主抗病毒RNA沉默,这些DEGs也可能是SsHADV-1在菌株DT-8中成功寄生和复制的关键因素。这些结果为进一步解析SsHADV-1感染对核盘菌全基因组转录的影响提供了基础。
文献:
Qu Z , Fu Y , Lin Y , et al. Transcriptional Responses of Sclerotinia sclerotiorum to the Infection by SsHADV-1[J]. Journal of Fungi, 2021, 7(7):493. https://doi.org/10.3390/jof7070493



