互作转录组可以帮助我们研究物种之间的寄生、感染、共生等互作用关系,只构建一个文库就可以对多个互作的物种进行表达量的研究。不过互作转录组说起来简单,做起来可不容易。
困难1:RNA量相对较低
比如,研究寄生菌和植物宿主之间的相互作用,取被寄生的植物叶片或根茎,提取RNA,那么绝大部分都是植物的RNA。再比如,研究病菌感染动物过程中两者的互作关系,取动物组织,提取RNA,那么绝大部分还是被感染动物的RNA。从多篇研究寄生、感染的文章的结果可以看到,比对到寄生物种或感染物种的测序数据通常不足百分之十,甚至低于百分之一。
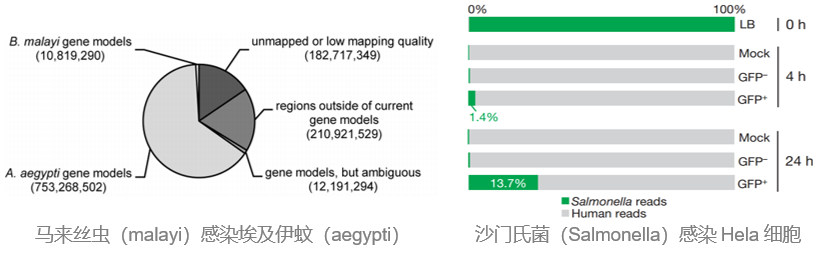
困难2:测序结果不准确
中低表达量基因的测序结果是不够准确的,这些基因极易受到建库PCR扩增的影响:所有的文库片段并非以同等速率扩增,扩增速率受到片段长度、GC含量、片段浓度等多方面的影响,容易扩增的片段极大的被富集,一些含量较低的片段或碱基偏好严重的片段甚至完全丢失。有文献证明,建库过程使用不同PCR扩增循环次数,会导致测序结果的不同,尤其是那些表达量不高的基因。这也解释了为何在对测序结果进行验证的时候,我们更倾向于选择表达量较高、差异倍数较大的基因进行验证。
寄生/感染物种的RNA仅占总体的一小部分,导致了它们容易受到建库PCR循环次数的影响,有时候为了检测低表达的基因还需要提高循环次数或测序深度,这就进一步放大了建库、测序的影响,测序的结果就更不准确了。
数字标签和互作转录组更配哦
对于PCR扩增的影响,康测科技已经有了完美的解决办法,那就是UMI(数字标签)。我们在逆转录获得cDNA片段后,给每一个片段添加独一无二的身份标签——UMI,经过多轮PCR之后,同一个片段扩增出来的片段都带有一样的UMI,这样我们就能够根据UMI,追溯到最初的那个片段,准确的还原样本的RNA组成,扩增多少个循环都不怕啦。
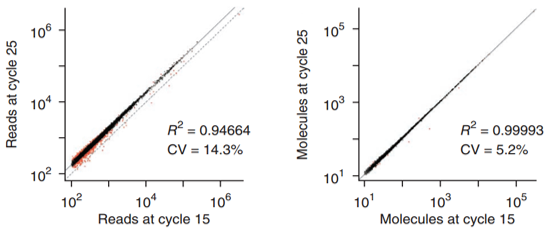
中低丰度基因更易受到不同PCR循环次数的影响(左),UMI可大大降低PCR的影响(右)
而且UMI还能帮我们纠正PCR扩增和测序产生的错误:扩增和测序的错误会使得相同UMI标签对应多个不同的序列,那么只需比较这些序列的相似性,即可纠正这些错误。
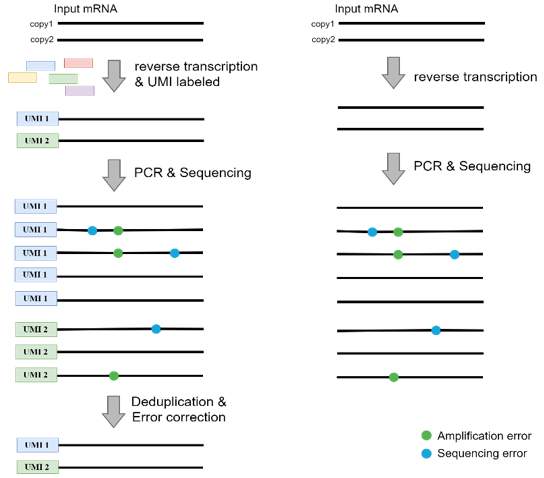
UMI定量及纠错的原理
寄生物种信息被宿主掩盖?感染初期检测不到病原体?想多扩增几个循环行不行?这些都不是问题,康测科技的互作转录组测序使用了UMI数字标签技术,统统都解决啦~
参考文献
[1] Westermann A J, Förstner K U,Amman F, et al. Dual RNA-seq unveils noncoding RNA functions in host-pathogeninteractions.[J]. Nature, 2016, 529(7587):496-501.
[2] Choi Y J, Aliota M T, et al. Dual RNA-seq of Parasite and Host Reveals Gene Expression Dynamics during Filarial Worm–Mosquito Interactions[J]. Plos Negl Trop Dis, 2014, 8(5):e2905.
[3] Kivioja T, Vähärautio A, Karlsson K, et al. Counting absolute numbers of molecules using unique molecular identifiers.[J]. Nature Methods, 2012, 9(1):72-74.



